广东省揭阳市第三中学2016届高三化学上学期周测试题
可能用到的相对原子质量:H 1 C 12 0 16 Na 23 Mg 24 Al 27 Cl 35.5
1.(2009?重庆)下列变化中属于化学变化的是( )
A.木柴劈成块 B.西瓜榨成汁 C.残雪化成水 D.高粱酿成酒
可能用到的相对原子质量H—1 C—12 O—16 Mg—24 Cl—36.5
1、 日常生活中发生的下列变化,属于化学变化的是( )
A. 水结成冰 B。纸张燃烧 C 玻璃破碎 D 汽油挥发
可能用到的相对原子质量:H—1,C—12,N—14,O—16,Na—23,Mg—24,Al—27,S—32,Cl—35.5,Ca—40,Fe—56,Zn—65,Ag—108
1.下列变化中属于化学变化的是
A.榨取果汁 B.粉碎废纸 C.燃放烟花 D.切割玻璃
可能用到的数据和资料:相对原子质量:H~1 C~12 O~16Fe~56
1.空气中含量较多且化学性质不活泼的气体是
A.氮气 B.氧气 C.稀有气体 D.二氧化碳
已知n(CO2)=0.5mol,以CO2为基本单元,问m(CO2)=?(相对原子质量:C=12,O=16)
广东省揭阳市第三中学2016届高三化学上学期周测试题可能用到的相对原子质量: H:1 C:12 N:14 Fe:56 一、单项选择题7下列说法不正确的是ANaHCO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨松剂B将“地沟油”蒸馏可以获得汽油C甲醛的水溶液俗称福尔马林,具有杀菌、防腐性能D医药中,常用酒精来消毒,是因为酒精能够使细菌蛋白质发生变性8NA表示阿伏伽德罗常数,下列判断正确的是A5.6g Fe与足量稀盐酸反应,转移电子数为0.2NA B标准状况下,22.4 L CH2Cl2中含有的氯原子数目为2NAC16g CH4与18 g NH4 所含质子数相等(相对原子质量:H:1 C:12 N:14)D1molL1 NaHCO3溶液中的Na+数为NA9下列反应的离子方程式中,书写正确的是A实验室用大理石跟稀盐酸制取二氧化碳:2H+ + CO32 CO2+ H2OB将铝粉投入氢氧化钠溶液中:2Al + 2OH 2AlO2 + H2C铁粉与氯化铁溶液反应:Fe + Fe3+ 2Fe2+D金属钠与水反应:2Na + 2H2O 2Na+ + 2OH-+ H210下列叙述和均正确并且有因果关系的是选项叙述叙述ANH4Cl是强酸弱碱盐将NH4Cl溶液蒸干可制备NH4Cl固体BFe3+有强氧化性用KSCN溶液可以鉴别Fe3+C Fe2+有还原性用Fe2+可使溴水褪色DCl2有漂白性用Cl2可与石灰乳反应制备含氯消毒剂11用下列实验装置进行的实验中,不能达到相应实验目的的是盐桥图 图 图 图A用图所示实验装置排空气法收集H2气体B图装置可以用来验证化学能转化为电能C图铁片最终完全溶解,且高锰酸钾溶液褪色D图所示实验可比较硫、碳、硅三种元素的非金属性强弱12已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是A非金属性:YZXBW的原子序数可能是Y的原子序数的2倍C气态氢化物稳定性:Yc(A-)c(H+)c(OH-)C常温下0.1 mol/L的醋酸溶液:c(CH3COOH)c(CH3COO-)c(H+)c(OH-)D0.1 molL NaAlO2溶液中:c(Na+)c(AlO)c(OH-)c(H+)26. (14分)硫酸亚铁晶体(FeSO47H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:硅孔雀石H2SO4溶浸浸出渣硫酸铜粗液MnO2浸出液除杂滤渣滤液硫酸铜晶体.请回答下列问题:(1)补血剂存放时间较长会氧化变质,对滤液中铁元素的存在形式提出如下假设: 假设1:只有Fe2+ 假设2:只有Fe3+ 假设3: 。(2)如何证明步骤滤液中含有Fe2+ 。 (3)步骤中一系列处理的操作步骤: 、洗涤、灼烧、 、称量。(4)该小组有些同学认为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定。用离子方程式表示该滴定原理: 。实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需 。重复滴定三次,消耗1.00 mol/L KMnO4标准溶液体积分别为19.98 mL、20.00 mL、20.02mL,3次实验所用Fe2+溶液的体积为20.00 mL。请根据以上数据,再设计合理数据,完成实验过程的记录表格。如何判断达到滴定终点: 。27(14分)某科研小组以难溶性钾长石(K2OAl2O36SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:(1)煅烧过程中有如下反应发生:钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式: 。钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式: 。(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2+ 2H2OAl(OH)3+ OH。“浸取”时应保持溶液呈_性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_ _。(3)“转化”时加入NaOH的主要作用是(用离子方程式表示) 。(4)上述工艺中可以循环利用的主要物质是_ _、_ _和水。28(15分)水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s) + H2O(g) CO (g) +H2 (g) H +131.3 kJmol1(1)该反应的平衡常数K随温度的升高而_(增大 / 减小 / 不变)。(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_(向左移 / 向右移 / 不移动)。(3)下列事实能说明该反应在一定条件下已达到平衡状态的有_(填序号)。A单位体积内每消耗1 mol CO的同时生成1molH2B混合气体总物质的量保持不变C生成H2O(g)的速率与消耗CO的速率相等DH2O(g)、CO、H2的浓度相等(4)上述反应在t0时刻达到平衡(如右图),若在t1时刻改变某一条件,请在右图中继续画出t1时刻之后c(CO)随时间的变化。 缩小容器体积(用实线表示)。 降低温度(用虚线表示)。(5)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应, C (s) + H2O(g) CO (g) +H2 (g),达到平衡时测得K= 1,求此温度下H2O(g)的转化率。(在答题卷上写出详细的计算过程)(6)己知: C (s) + H2O(l) CO (g) +H2 (g) H1 2CO(g) + O2(g) 2CO2 (g) H 2 H2O (l) H2 (g) +1/2 O2 (g) H 3则2C (s) + 2O2 (g) 2CO2 (g)的H _ _。36.化学化学与技术:暂不提供37.化学物质结构与性质:暂不提供38.化学有机化学基础(15分)已知为合成某种液晶材料的中间体M,有人提出如下
铁锈的化学式可以直接表式为Fe(OH)3问a.铁锈中各元素的百分数是多少?b.当1千克铁被腐蚀,生成多少克铁锈?相对原子质量Fe=55.8;O=16;H=1
相对原子质量(原子量):H 1 C 12 N 14 Cl 35.5 Fe 56
一、选择题(本题共17小题。在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.乙肝疫苗的接种需在一定时期内间隔注射三次,其目的是
A.使机体积累更多数量的疫苗
B.使机体产生更多种类的淋巴细胞
C.使机体产生更多数量的抗体和淋巴细胞
D.使机体产生更强的非特异性免疫
B.Zn
C.Mg
D.Ag
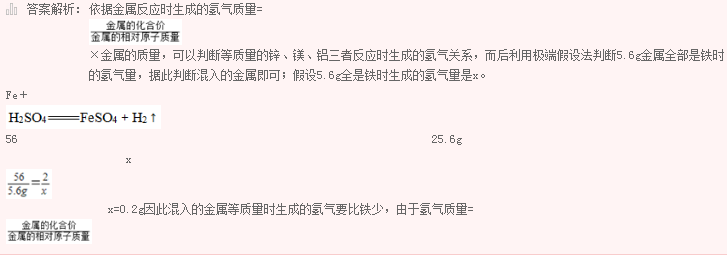
已知常见元素的相对原子质量为H为1;O为16;C为12;N为14。在下列几种常见的气体中,()的相对分子质量最大。
- A、N2
- B、C02
- C、H2
- D、02
正确答案:B
固体碳酸盐的分解温度是指()
- A、分解产生的CO2的分压等于该气体在空气中的分压时的温度
- B、分解产生的CO2的分压等于或大于该气体在空气中的分压时的温度
- C、分解产生的CO2的分压等于外界大气压时的温度
- D、分解产生的CO2的分压等于101.325KPa时的温度
正确答案:D
