符合新药报批人体生物利用度实验参数要求的叙述为A.药物动力学参数均应由计算得到B.AUC应当用积分方程计算得到C.Cmax和Tmax应当使用实测值D.双隔室模型的动力学参数α、β具有实际动力学意义E.T1/2的数据不能由缓控释制剂的药动学数据得到
题目
符合新药报批人体生物利用度实验参数要求的叙述为
A.药物动力学参数均应由计算得到
B.AUC应当用积分方程计算得到
C.Cmax和Tmax应当使用实测值
D.双隔室模型的动力学参数α、β具有实际动力学意义
E.T1/2的数据不能由缓控释制剂的药动学数据得到
相似考题
更多“符合新药报批人体生物利用度实验参数要求的叙述为A.药物动力学参数均应由计算得到B.AUC应当用积 ”相关问题
-
第1题:
群体药代动力学的意义不包括
A、能制订出较为可信的个体化给药方案
B、可计算出群体平均药动学参数
C、新药开发
D、进行生物利用度研究
E、用药效学模型代替药动学模型
参考答案:B
-
第2题:
符合新药报批人体生物利用度实验设计要求的叙述为
A.生物利用度研究的用药剂量一般与临床用药剂量一致,但特殊情况可适当增加剂量
B.生物利用度研究的用药剂量必须按照高、中、低三个剂量分别进行研究,以考察剂量对生物利用度的影响
C.两个试验周期至少应间隔受试药物的2~3个半衰期.通常间隔1~2天
D.进行多次给药生物利用度研究时,确定稳态时间时应通过计算而得到
E.受试期间受试者因为身体较为虚弱,进餐应当多提供高脂肪、高蛋白食物
正确答案:A
-
第3题:
用以表示药物在体内分布程度的药物代谢动力学参数是
A.吸收速率常数
B.生物利用度
C.表观分布容积
D.生物半衰期
E.清除率
正确答案:C
-
第4题:
符合新药报批人体生物利用度实验要求的叙述为
A.生物利用度的计算结果只能由血药浓度得到
B.不能用代谢产物求算生物利用度
C.缓控释制剂的药动学参数除一般的外,还应提供可以描述缓控释制剂特殊释放行为的动力学参数
D.生物等效性评价采用双单侧检验,对AUC和Cmax直接进行统计分析
E.若受试制剂的AUC的95%.的可信限在标准参比制剂的95%.~105%.的范围内,可以认为两种制剂生物等效
正确答案:C
-
第5题:
群体药代动力学的意义不包括A.能制订出较为可信的个体化给药方案
B.可计算出群体平均药动学参数
C.新药开发
D.进行生物利用度研究
E.用药效学模型代替药动学模型答案:B解析:群体药代动力学的意义包括:①个体化给药;②生物利用度研究;③新药开发;④用药效学模型代替药动学模型。 -
第6题:
A.相对生物利用度
B.绝对生物利用度
C.生物等效性
D.肠肝循环
E.生物利用度反映其吸收程度和速度的主要药物动力学参数无统计学差异的是答案:C解析:本组题考查生物利用度和生物等效性。生物利用度是指剂型中的药物进入体循环的速度和程度,根据参比制剂的不同,分为绝对生物利用度和相对生物利用度。生物等效性是指一种药物的不同制剂在相同条件下,给以相同剂量,反映其吸收程度和速度的主要药物动力学参数,无统计学差异。故本组题答案应选C。 -
第7题:
符合新药报批人体生物利用度试验要求的是()
- A、进行单次给药生物利用度研究时,除服药时饮用水外,试验期间不得再饮用水,以防止血药浓度波动
- B、进行单次给药生物利用度研究时,服药4小时后统一进食,用200~250ml的温水送服药物
- C、进行单次给药生物利用度研究时,实验前一天应当开始禁食(至少24小时),次日早晨随食物一起服用药物
- D、进行多次给药生物利用度研究时,药物和食物应当一同服用
- E、进行多次给药生物利用度研究时,食物应由受试者自行决定
正确答案:B -
第8题:
采用尿排泄数据求算药物动力学参数应符合哪些条件?
正确答案:①至少有一部分或大部分药物以原形从尿中排泄,从而可以方便的测定尿药浓度,计算尿药量;
②假设药物经肾排泄过程亦服从一级动力学过程,则尿中原形药物排泄的速率与该时体内药物量成正比关系。 -
第9题:
承担并参加Ⅰ期临床的生物等效性试验。提示:依据《中国药典》2005年版二部和《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》的要求下列有关叙述中,哪些是正确的()
- A、生物利用度是指剂型中的药物被吸收进入血液的速率和程度
- B、生物利用度是指一种药物的不同制剂在相同的试验条件下,给以相同的剂量,反映其吸收速率和程度的主要动力学参数没有明显的统计学差异
- C、生物等效性是指剂型中的药物被吸收进入血液的速率和程度
- D、生物等效性是指一种药物的不同制剂在相同的试验条件下,给以相同的剂量,反映其吸收速率和程度的主要动力学参数没有明显的统计学差异
- E、生物利用度有绝对生物利用度和相对生物利用度之分
- F、化学药品属注册分类6中的口服固体制剂应当进行生物等效性试验
正确答案:A,D,E,F -
第10题:
判断题体内药物分析为生物药剂学提供动力学参数及生物利用度的信息。A对
B错
正确答案: 对解析: 暂无解析 -
第11题:
单选题关于生物利用度研究的基本要求和方法,叙述正确的是()A生物利用度是指一种药物的不同制剂在相同实验条件下,给予相同的剂量,其吸收速度与程度没有明显差别
B绝对生物利用度研究选用同类上市主导产品作为参比制剂
C生物利用度试验采用随机分组实验设计方法
D生物利用度试验的清洗期有助于避免前一次用药对后一次用药药动学参数的影响
E给药剂量应低于临床单次给药剂量
正确答案: A解析: 暂无解析 -
第12题:
填空题人体生物力学参数包括人体惯性参数、()、动力学参数及生物学参数。正确答案: 运动参数解析: 暂无解析 -
第13题:
符合新药报批人体生物利用度实验要求的叙述为
A.在利用高效液相色谱法测定样品过程中,如果样品中内源性物质干扰样品的测定,但内源性物质的响应信号重复性较为一致,也可以认为该分析方法合理
B.对生物样品进行分析的精密度可以适当放宽,可以达到15%.,甚至20%.
C.对生物样品进行分析的回收率实验中,一般来说采用方法回收率和提取回收两种方法,但实际上两者的测定目的是一样的
D.对生物样品进行分析的稳定性实验可以不必考虑冻融实验
E.人体生物利用度实验追踪的物质必须为药物原型物质,不应追踪代谢产物或衍生化物
正确答案:B
-
第14题:
符合药物动力学实验研究的叙述为
A.不能用代谢产物求算生物利用度
B.表观分布体积是指人体体液具有的确切体积
C.多次给药的达稳态的时间由计算得到
D.AUC应当用梯形法计算得到
E.消除速度常数只能由静脉注射给药得到
正确答案:D
-
第15题:
符合新药报批人体生物利用度实验要求的叙述为
A.选用测定样品必须为血浆
B.采样时间越长越好,最好应持续到测定时超出测定的灵敏度为止
C.取血时间点宜越密越好,以保证数据的真实可靠
D.总采样点最少不应少于10个,且分布要合理
E.采样点的分布只需照应到分布相和消除相即可
正确答案:D
-
第16题:
描述药物转运(消除)快慢的动力学参数是A.速率常数
B.生物等效性
C.表观分布容积
D.稳态血药浓度
E.相对生物利用度答案:A解析:本组题考查常用药物动力学参数。速率常数是描述药物转运(消除)速度的动力学参数;生物等效性指含有相同活性物质的两种药品药剂学等效或药剂学可替代,并且它们在相同摩尔剂量下给药后,生物利用度落在预定的可接受限度内,即两制剂具相似的安全性和有效性;表观分布容积是体内药量(X)与血药浓度(C)的比值;稳态血药浓度是药物的消除速度等于药物的输入速度;试验制剂与参比制剂的血药浓度一时间曲线下面积的比率称为相对生物利用度。 -
第17题:
药物人体生物利用度试验必需提供的动力学参数有A.MIC,MEC,AUC,t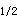
B.T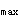 ,F,Kr,AUC
,F,Kr,AUC
C.C ,T
,T ,t
,t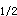 ,AUC
,AUC
D.T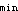 ,T
,T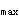 ,F,D
,F,D
E.C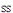 ,C
,C ,C
,C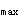 ,C
,C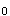 答案:C解析:任何药物人体生物利用度试验及药代动力学试验,必需提供的动力学参数包括C
答案:C解析:任何药物人体生物利用度试验及药代动力学试验,必需提供的动力学参数包括C 、T
、T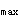 、t
、t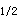 、AUC,所以答案为C。
、AUC,所以答案为C。 -
第18题:
反映其吸收程度和速度的主要药物动力学参数无统计学差异的是查看材料A.相对生物利用度
B.绝对生物利用度
C.生物等效性
D.肠-肝循环
E.生物利用度答案:C解析:本组题考查生物利用度和生物等效性。生物利用度是指剂型中的药物进入体循环的速度和程度,根据参比制剂的不同,分为绝对生物利用度和相对生物利用度。生物等效性是指一种药物的不同制剂在相同条件下,给以相同剂量,反映其吸收程度和速度的主要药物动力学参数,无统计学差异。 -
第19题:
用以表示药物在体内分布程度的药物代谢动力学参数是()
- A、吸收速率常数
- B、生物利用度
- C、表观分布容积
- D、生物半衰期
- E、清除率
正确答案:C -
第20题:
体内药物分析为生物药剂学提供动力学参数及生物利用度的信息。
正确答案:错误 -
第21题:
药代动力学参数中,Vd代表(),F代表生物利用度,Ke代表一级消除动力学的消除速率常数。
正确答案:表观分布容积 -
第22题:
单选题反映其吸收程度和速度的主要药物动力学参数无统计学差异的是( )。A相对生物利用度
B绝对生物利用度
C生物等效性
D肠肝循环
E生物利用度
正确答案: C解析: -
第23题:
单选题用以表示药物在体内分布程度的药物代谢动力学参数是()A吸收速率常数
B生物利用度
C表观分布容积
D生物半衰期
E清除率
正确答案: E解析: 本题考查药物代谢动力学评价部分的内容,主要是其参数概念的理解。
