由电对MnO4-/Mn2+和电对Fe3+/Fe2+组成原电池,已知φ MnO4-/Mn2+,φ Fe3+/Fe2+,则电池反应的产物为: A. Fe3+和Mn2+ B. MnO4-和Fe3+ C. Mn2+和Fe2+ D. MnO4-和Fe2+
题目
B. MnO4-和Fe3+
C. Mn2+和Fe2+
D. MnO4-和Fe2+
相似考题
更多“由电对MnO4-/Mn2+和电对Fe3+/Fe2+组成原电池,已知φ MnO4-/Mn2+,φ Fe3+/Fe2+,则电池反应的产物为: ”相关问题
-
第1题:
已知E?(Fe3+/Fe2+)=0.77V,E?(MnO4-/Mn2+)=1.51V,当同时提高两电对电极的酸度时,两电对电极电势数值的变化是( )。
A.E?(Fe3+/Fe2+)变小,E?(MnO4-/Mn2+)变大
B.E?(Fe3+/Fe2+)变大,E?(MnO4-/Mn2+)变大
C.E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)变大
D.E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)不变答案:C解析:电极电势与物质的本性、物质的浓度、温度有关,一般温度的影响较小。Fe3++e_=Fe2+,与H+浓度无关;MnO4-+8H++5e_=Mn2++4H2O,H+参与了该反应。因此,E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)变大。 -
第2题:
由电对MnO4-/Mn2+和电对Fe3+/Fe2+组成原电池,已知φ MnO4-/Mn2+,φ Fe3+/Fe2+,
则电池反应的产物为:
A. Fe3+和Mn2+ B. MnO4-和Fe3+ C. Mn2+和Fe2+ D. MnO4-和Fe2+答案:A解析:提示:电极电势高的电对作正极,电极电势低的电对作负极。正极发生的电极反应是氧化剂的还原反应,负极发生的是还原剂的氧化反应。即
MnO4-+8H++5e-=Mn2++4H2O
Fe2+-e-=Fe3+ -
第3题:
其他条件不变时,能使电对MnO4-/Mn2+的电极电位增大的方法是()
- A、增大pH
- B、降低pH
- C、增大Mn2+浓度
- D、前三个都可以
正确答案:B -
第4题:
对于EA(MnO4-/Mn2+)来说,下列叙述中正确的是()。
- A、Mn2+浓度增大则E值增大
- B、H+浓度的变化对E的影响比Mn2+浓度变化的影响大
- C、溶液稀释,c(MnO4-)/c(Mn2+)值不变,E值也不改变
- D、MnO4-浓度减小,E值增大
正确答案:B -
第5题:
MnO4-与Fe2+反应的平衡常数()。已知jθ(MnO4-/Mn2+)=1.51V,jθ(Fe3+/Fe2+)=0.77V
- A、3.4×1012
- B、320
- C、3.0×1062
- D、4.2×1053
正确答案:C -
第6题:
已知在1mol·L-1H2SO4溶液中,EΘ(MnO4-/Mn2+)=1.45V,EΘ(Fe3+/Fe2+)=0.68V,在此条件下用KMnO4-标准溶液滴定Fe2+,求化学计量点的电位值为()
- A、0.38V
- B、0.73V
- C、0.89V
- D、1.32V
- E、1.49V
正确答案:D -
第7题:
增加溶液的离子强度,Fe3+/Fe2+电对的条件电势升高。
正确答案:错误 -
第8题:
已知在1mol/LH2SO4溶液中,Eθ’(MnO4-/Mn2+)=1.45V,Eθ’(Fe3+/Fe2+)=0.68V。在此条件下用KMnO4标准溶液滴定Fe2+,期计量点的电位为()
- A、1.49V
- B、1.32V
- C、0.89V
- D、0.73V
正确答案:B -
第9题:
对于电池的符号为:(-)Pt|Sn4+,Sn2+‖Fe3+,Fe2+|Pt(+),则此电池反应的产物为()。
- A、Fe3+,Sn2+
- B、Sn4+,Fe2+
- C、Sn4+,Fe3+
- D、Sn2+,Fe2+
正确答案:B -
第10题:
在Cr3+、Mn2+、Fe2+、Fe3+、Co2+、Ni2+中,易溶于过量氨水的是()
正确答案:Co2+、Ni2+ -
第11题:
单选题以电对MnO-4/Mn2+与Fe3+/Fe2+电对组成原电池,已知则反应产物是()。AMnO4和Fe2+
BMnO4和Fe3+
CMn2++和Fe2+
DMn2+和Fe3+
正确答案: C解析: 暂无解析 -
第12题:
单选题已知φθ(Fe3+/Fe2+)=0.771V,φθ(Cd2+/Cd)=-0.4030V,将这两电对组成原电池,则电池的标准电动势为()。A1.174
B0.059
C0.973
D0.368
正确答案: B解析: 暂无解析 -
第13题:
下列叙述中哪一个不正确?A.对半反应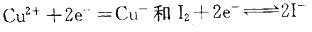 ,离子浓度升髙,它们的电极电势增加
,离子浓度升髙,它们的电极电势增加
B.已知 ,所以氧化性的强弱为MnO4- >Cr2O72-
,所以氧化性的强弱为MnO4- >Cr2O72-
C.反应 能自发进行,组成原电池时正极为Fe3+ (C1)、Fe2+ (C2) Pt,负极为 Cu Cu2+ (C3)
能自发进行,组成原电池时正极为Fe3+ (C1)、Fe2+ (C2) Pt,负极为 Cu Cu2+ (C3)
D.腐蚀电池中,电极电势低的是阳极,可被腐蚀掉答案:A解析: B正确。利用电极电势的大小,可以判断电对中氧化态物质的氧化性强弱和还原态物质的还原性强弱。电极电势越高的电对中,氧化态物质的氧化性越强。所以氧化性:MnO4- >Cr2O72-
B正确。利用电极电势的大小,可以判断电对中氧化态物质的氧化性强弱和还原态物质的还原性强弱。电极电势越高的电对中,氧化态物质的氧化性越强。所以氧化性:MnO4- >Cr2O72-
C正确。自发进行的氧化还原反应组成原电池时,其电动势(E)一定大于零,即
E=φ正-φ负=φ氧化剂-φ还原剂>0
从反应前后物质的氧化数变化来分析,可得出Fe3+为氧化剂,Cu为还原剂,所以φFe3+/Fe2+ >φCu2+/Cu。电极电势高的为正极,电极电势低的为负极。故原电池中正极为Fe3+ (C1)、Fe2+ (C2) Pt,负极为 Cu Cu2+ (C3)。
D正确。因为在腐蚀电池中,电极电势低的为阳极,发生氧化反应而被腐蚀掉;电极电势高的为阴极,发生还原反应不可能被腐蚀。
所以答案为A。 -
第14题:
对于电池的符号为: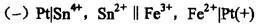 ,则此电池反应的产物为 ( )。
,则此电池反应的产物为 ( )。
A. Fe3+,Sn2+ B. Sn4+,Fe2+ C. Sn4+, Fe3+ D. Sn2+, Fe2+答案:B解析:提示:负极的反应为Sn2+-2e=Sn4+,正极的反应为Fe3++e=Fe2+,因此反应产物为 Sn4+和 Fe2+。 -
第15题:
在标准条件下将氧化还原反应Fe2++Ag+Fe3++Ag装配成原电池,原电池符号为()
- A、(-)Fe2+|Fe3+‖Ag+½Ag(+)
- B、(-)Ag|Ag+‖Fe3+½Fe2+(+)
- C、(-)Pt|Fe2+,Fe3+‖Ag+½Ag(+)
- D、(-)Ag|Ag+‖Fe2+,Fe3+½Pt(+)
正确答案:C -
第16题:
已知φθFe3+/Fe2+=0.77V,当溶液中[Fe3+]=0.0001mol/l,[Fe2+]=0.1000mol/l时,则半反应Fe3++e=Fe2+电极电位φFe3+/Fe2+=()。
正确答案:0.59 -
第17题:
将反应Fe2++Ag+→Fe3++Ag构成原电池,其电池符号为()。
- A、(-)Fe2+∣Fe3+‖Ag+∣Ag(+)
- B、(-)Pt∣Fe2+∣Fe3+‖Ag+∣Ag(+)
- C、(-)Pt∣Fe2+.Fe3+‖Ag+∣Ag(+)
- D、(-)Pt∣Fe2+,Fe3+‖Ag+∣Ag∣Pt(+)
正确答案:C -
第18题:
已知Fe3++e=Fe2+的φΘ=0.770V,在101325Pa和298.15K时,所测得电对Fe3+/Fe2+的φ=0.750V,则该电极溶液中离子浓度必定是()
- A、[Fe3+] > 1 mol.L-1
- B、[Fe3+] < 1 mol.L-1
- C、[Fe3+]/[ Fe2+] < 1
- D、[Fe3+]/[ Fe2+] > 1
正确答案:C -
第19题:
已知反应:Sn2+ +2 Fe3+ === Sn4+ +2 Fe2+ ,用电池符号表示原电池的组成。
正确答案: (-)Pt| Sn2+(c1), Sn4+(c2) || Fe3+(c3), Fe2+(c4)| Pt(+) -
第20题:
已知φθ(Fe3+/Fe2+)=0.771V,φθ(Cd2+/Cd)=-0.4030V,将这两电对组成原电池,则电池的标准电动势为()。
- A、1.174
- B、0.059
- C、0.973
- D、0.368
正确答案:A -
第21题:
以电对MnO-4/Mn2+与Fe3+/Fe2+电对组成原电池,已知则反应产物是()。
- A、MnO4和Fe2+
- B、MnO4和Fe3+
- C、Mn2++和Fe2+
- D、Mn2+和Fe3+
正确答案:D -
第22题:
下列四种酸性未知液的定性报告合理是()
- A、K+,NO2-,MnO4-,CrO42-
- B、Fe2+,Mn2+,SO42-,Cl-
- C、Fe3+,CO32-,I-,Cl-
- D、Cr2O72-,Ba2+,NO3-,Br-
正确答案:B -
第23题:
单选题已知Eϴ(Fe3+/Fe2+)=0.77V,Eϴ(MnO4-/Mn2+)=1.51V,当同时提高两电对电极的酸度时,两电对电极电势数值的变化是( )。[2019年真题]AEϴ(Fe3+/Fe2+)变小,Eϴ(MnO4-/Mn2+)变大
BEϴ(Fe3+/Fe2+)变大,Eϴ(MnO4-/Mn2+)变大
CEϴ(Fe3+/Fe2+)不变,Eϴ(MnO4-/Mn2+)变大
DEϴ(Fe3+/Fe2+)不变,Eϴ(MnO4-/Mn2+)不变
正确答案: B解析:
电极电势与物质的本性、物质的浓度、温度有关,一般温度的影响较小。Fe3++e_=Fe2+,与H+浓度无关;MnO4-+8H++5e_=Mn2++4H2O,H+参与了该反应。因此,Eϴ(Fe3+/Fe2+)不变,Eϴ(MnO4-/Mn2+)变大。
