专题09 反应速率、化学平衡——三年(20202022)高考真题化学分项汇编(全国通用)(原卷版)
A、化学平衡向正反应方向移动
B、化学平衡向逆反应方向移动
C、化学平衡不移动
D、容器内反应速度加快(正、逆速度均加快)
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是:
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
B.反应物的转化率
C.正、逆反应速率
D.体系的压强
B、只有平衡移动才能改变反应物的转化率,所以反应物的转化率改变时,化学平衡一定发生了移动,故B正确.C、使用合适的催化剂,正、逆反应速率都改变,但平衡不移动,故C错误;
D、如果反应前后气体总物质的量不变,则压强对平衡无影响,故D错误.
故选B.
B、正、逆反应速率改变时,平衡一定发生移动
C、对于任何可逆反应,使用催化剂只改变反应速率,不影响平衡
D、增大体系压强、化学反应速率加快,化学平衡一定正向移动
专题09 反应速率、化学平衡1(2022广东卷)恒容密闭容器中,在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是A该反应的Ba为随温度的变化曲线C向平衡体系中充入惰性气体,平衡不移动D向平衡体系中加入,H2的平衡转化率增大2(2022广东卷)在相同条件下研究催化剂I、对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,则A无催化剂时,反应不能进行B与催化剂相比,使反应活化能更低Ca曲线表示使用催化剂时X的浓度随t的变化D使用催化剂时,内,3(2022浙江卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是A实验,B实验,时处于平衡状态,C相同条件下,增加氨气的浓度,反应速率增大D相同条件下,增加催化剂的表面积,反应速率增大4(2022浙江卷)关于反应,达到平衡后,下列说法不正确的是A升高温度,氯水中的减小B氯水中加入少量醋酸钠固体,上述平衡正向移动,增大C取氯水稀释,增大D取两份氯水,分别滴加溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度5(2022湖南卷)向体积均为1L的两恒容容器中分别充入和发生反应:,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是AB气体的总物质的量:Ca点平衡常数:D反应速率:1(2021广东)反应经历两步:;。反应体系中、的浓度c随时间t的变化曲线如图所示。下列说法不正确的是Aa为随t的变化曲线B时,C时,的消耗速率大于生成速率D后,2(2021河北)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:M+N=X+Y;M+N=X+Z,反应的速率可表示为v1=k1c2(M),反应的速率可表示为v2=k2c2(M) (k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是A030min时间段内,Y的平均反应速率为6.6710-8molL-1min-1B反应开始后,体系中Y和Z的浓度之比保持不变C如果反应能进行到底,反应结束时62.5%的M转化为ZD反应的活化能比反应的活化能大3(2021浙江)相同温度和压强下,关于物质熵的大小比较,合理的是ABCD4(2021浙江)一定温度下:在的四氯化碳溶液()中发生分解反应:。在不同时刻测量放出的体积,换算成浓度如下表:06001200171022202820x1.400.960.660.480.350.240.12下列说法正确的是A,生成的平均速率为B反应时,放出的体积为(标准状况)C反应达到平衡时,D推测上表中的x为39305(2021浙江)取50 mL过氧化氢水溶液,在少量I- 存在下分解:2H2O2=2H2O+O2。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:t/min020406080c/(molL-1)0.800.400.200.100.050下列说法不正确的是A反应20min时,测得O2体积为224mL(标准状况)B2040min,消耗H2O2的平均速率为0.010molL-1min-1C第30min时的瞬时速率小于第50min时的瞬时速率DH2O2分解酶或Fe2O3代替I-也可以催化H2O2分解6(2021浙江)在298.15 K、100 kPa条件下,N2(g) +3H2 (g)=2NH3(g) H=-92.4 kJmol-1,N2 (g) 、H2(g)和NH3(g)的比热容分别为29.1、28.9和35.6JK-1mol-1。一定压强下,1 mol反应中,反应物N2(g) +3H2(g)、生成物2NH3(g)的能量随温度T的变化示意图合理的是ABCD7(2021湖南)已知:,向一恒温恒容的密闭容器中充入和发生反应,时达到平衡状态I,在时改变某一条件,时重新达到平衡状态,正反应速率随时间的变化如图所示。下列说法正确的是A容器内压强不变,表明反应达到平衡B时改变的条件:向容器中加入CC平衡时A的体积分数:D平衡常数K:8(2021北京高考真题)有科学研究提出:锂电池负极材料(Li)由于生成LH而不利于电池容量的保持。一定温度下,利用足量重水(D2O)与含LiH的Li负极材料反应,通过测定n(D2)/n(HD)可以获知 n(Li)/n(LiH)。已知:LiH+H2O=LiOH+H22Li(s)+H22LiH H0下列说法不正确的是A可用质谱区分D2和HDBLi与D2O的反应:2Li+2D2O=2LiOD+D2C若n(Li)/n(LiH)越大,则n(D2)/n(HD)越小D80反应所得n(D2)/n(HD)比25反应所得n(D2)/n(HD)大9(2021北京高考真题)丙烷经催化脱氢可制丙烯:C3H8C3H6+H2。600,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。已知:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) H=-2220kJ/molC3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) H=-2058kJ/molH2(g)+1/2O2(g)=H2O(l) H=-286kJ/mol下列说法不正确的是AC3H8(g)=C3H6(g)+H2(g) H=+124kJ/molBc(H2)和c(C3H6)变化差异的原因:CO2+H2CO+H2OC其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大D若体系只有C3H6、CO、H2和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6)10(2021辽宁高考真题)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是 A其他条件相同时,催化剂浓度越大,反应速率越大B其他条件相同时,降冰片烯浓度越大,反应速率越大C条件,反应速率为D条件,降冰片烯起始浓度为时,半衰期为11(2021辽宁高考真题)某温度下,在恒容密闭容器中加入一定量X,发生反应,一段时间后达到平衡。下列说法错误的是A升高温度,若增大,则B加入一定量Z,达新平衡后减小C加入等物质的量的Y和Z,达新平衡后增大D加入一定量氩气,平衡不移动12(2021海南高考真题)制备水煤气的反应 ,下列说法正确的是A该反应B升高温度,反应速率增大C恒温下,增大总压,H2O(g)的平衡转化率不变D恒温恒压下,加入催化剂,平衡常数增大13(2021福建高考真题)实验室配制碘水时,通常将溶于溶液:。关于该溶液,下列说法正确的是A的电子式为B滴入淀粉溶液,不变蓝C加水稀释,平衡逆向移动D加少量固体平衡正向移动14(2021江苏高考真题)N2是合成氨工业的重要原料,NH3不仅可制造化肥,还能通过催化氧化生产HNO3;HNO3能溶解Cu、Ag等金属,也能与许多有机化合物发生反应;在高温或放电条件下,N2与O2反应生成NO,NO进一步氧化生成NO2。2NO(g)+O2(g)=2NO2(g) H=-116.4kJmol-1。大气中过量的NOx和水体中过量的NH、NO均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2,也可将水体中的NO3-转化为N2。对于反应2NO(g)+O2(g)2NO2(g),下列说法正确的是A该反应的H0,S0B反应的平衡常数可表示为K=C使用高效催化剂能降低反应的焓变D其他条件相同,增大,NO的转化率下降15(2021江苏高考真题)NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择性100%与温度的关系如图所示。 下列说法正确的是A其他条件不变,升高温度,NH3的平衡转化率增大B其他条件不变,在175300 范围,随温度的升高,出口处N2和氮氧化物的量均不断增大C催化氧化除去尾气中的NH3应选择反应温度高于250 D高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂 12020浙江7月选考溶液与溶液发生反应:,达到平衡。下列说法不正确的是( )A加入苯,振荡,平衡正向移动B经苯2次萃取分离后,在水溶液中加入,溶液呈血红色,表明该化学反应存在限度C加入固体,平衡逆向移动D该反应的平衡常数22020浙江7月选考一定条件下: 。在测定的相对分子质量时,下列条件中,测定结果误差最小的是( )A温度、压强 B温度、压强C温度、压强 D温度、压强32020天津卷已知呈粉红色,呈蓝色,为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:,用该溶液做实验,溶液的颜色变化如下:以下结论和解释正确的是A等物质的量的和中键数之比为3:2B由实验可推知H0C实验是由于c(H2O)增大,导致平衡逆向移动D由实验可知配离子的稳定性:42020年山东新高考1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子();第二步Br -进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。已知在0和40时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。下列说法正确的是A1,4-加成产物比1,2-加成产物稳定B与0相比,40时1,3-丁二烯的转化率增大C从0升至40,1,2-加成正反应速率增大,1,4-加成正反应速率减小D从0升至40,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度52020江苏卷CH4与CO2重整生成H2和CO的过程中主要发生下列反应在恒压、反应物起始物质的量比条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是A升高温度、增大压强均有利于提高CH4的平衡转化率B曲线B表示CH4的平衡转化率随温度的变化C相同条件下,改用高效催化剂能使曲线A和曲线B相重叠D恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值

物质的量为8 mol。下列说法正确的是( )。《》()
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7 mol
D.C0的平衡转化率为80%

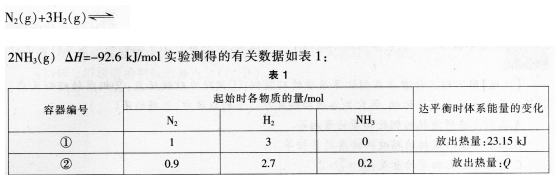
下列叙述中,正确的是()。
B.平衡时,①容器中N2的转化率为25%
C.容器①和②中反应的平衡常数不相等
D.若容器①体积为0.5L,则平衡时放出的热量大于23.15KJ

B.反应物的转化率
C.正、逆反应速率
D.体系的压强
B、只有平衡移动才能改变反应物的转化率,所以反应物的转化率改变时,化学平衡一定发生了移动,故B正确.C、使用合适的催化剂,正、逆反应速率都改变,但平衡不移动,故C错误;
D、如果反应前后气体总物质的量不变,则压强对平衡无影响,故D错误.
故选B.

各容器中起始物质的量浓度与反应温度如表1所示,反应过程中甲、丙容器中 C02的物质的量随时间变化关系如图2所示:
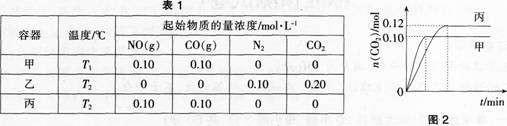
下列说法正确的是( )。
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol N0和0.10 molC02,此时v(正)<v(逆)
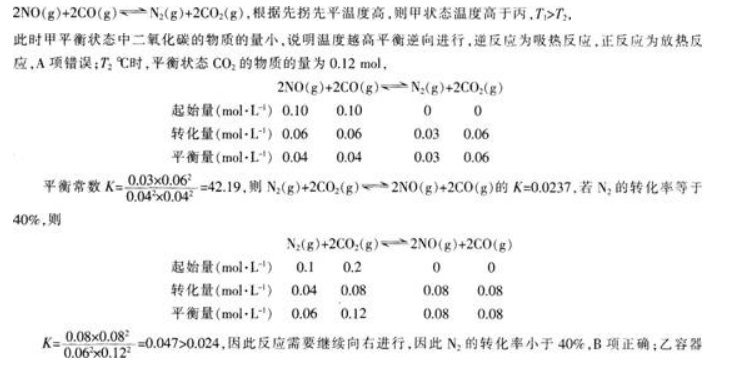
中的气体相当于甲中气体的2倍,建立平衡后,相当于甲平衡后增大压强,平衡向右移动.气体的物质的量减少,压强小于甲容器的2倍,C项错误;丙容器中反应达到平衡后,再充人0.10 mol NO和0.10 mol CO2.相当于增大压强,平衡正向移动,此时υ(正)大于υ(逆),D项错误;故本题选B。
B.升高温度,C的体积分数增大
C.充入惰性气体增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D.再充入1 mol C,C的物质的量浓度将增大
更多 “专题09 反应速率、化学平衡——三年(20202022)高考真题化学分项汇编(全国通用)(原卷版)” 相关考题
相关内容
最新试卷
热门试卷
- 西安交通大学806化工原理历年考研真题汇编-
- 中南大学商学院967管理学历年考研真题汇编(含部分答案)-
- 同济大学生命科学与技术学院631生物化学与分子生物学历年考研真题汇编(含部分答案)-
- 郑州大学物理工程学院651生物化学(一)历年考研真题汇编-
- 苏州大学物理与光电•能源学部641材料物理历年考研真题汇编-
- 西安交通大学外国语学院736英语基础历年考研真题汇编-
- 西南政法大学外语学院705基础英语历年考研真题汇编-
- 武汉理工大学化学化工与生命科学学院896化工原理历年考研真题汇编(含部分答案)-
- 天津大学化工学院861食品化学历年考研真题汇编-
- 武汉理工大学管理学院881运筹学历年考研真题汇编(含部分答案)-
