由下列电极反应的标准电极电位,计算AgBr的溶度积。 Ag+ + e = Ag φoAg+/Ag = 0.7990V AgBr + e = Ag + Br- φoAgBr/Ag = 0.0730V
题目
由下列电极反应的标准电极电位,计算AgBr的溶度积。 Ag+ + e = Ag φoAg+/Ag = 0.7990V AgBr + e = Ag + Br- φoAgBr/Ag = 0.0730V
相似考题
更多“由下列电极反应的标准电极电位,计算AgBr的溶度积。 Ag+ + e = Ag φoAg+/Ag = 0.7990V AgBr + e = Ag + Br- φoAgBr/Ag = 0.0730V”相关问题
-
第1题:
难溶化合物AgCl其溶度积的表示应写成()。A.[Ag+][Cl-]
B.Ksp=[Ag+][Cl-]
C.KspAgCl=[Ag+][Cl-]
D.QspAgCl=[Ag+][Cl-]
参考答案:C
-
第2题:
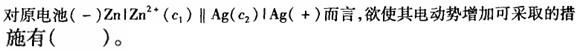 A.
A.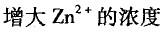
B.增加Ag+的浓度
C.加大锌电极面积
D.增加Ag电极的面积答案:B解析: -
第3题:
下列反应不正确的是()
- A、Ag2O+2HF==2AgF+H2O
- B、AgCl+2NH3==〔Ag(NH3)2〕++Cl-
- C、Ag++F-==AgF↓
- D、AgBr==Ag+Br(光子)
正确答案:C -
第4题:
已知φΘ(Ag+/Ag)、φΘ(AgI/Ag)、φΘ(AgBr/Ag)、φΘ(AgCl/Ag)分别用1、2、3、4表示,其φΘ值从大到小的顺序是()
- A、2>3>4>1
- B、1>4>3>2
- C、4>3>2>1
- D、3>1>2>4
正确答案:B -
第5题:
下列各电极的φΘ大小的顺序是() (1)φΘ(Ag+/Ag) (2)φΘ(AgI/Ag) (3)φΘ(Ag2S/Ag) (4)φΘ(AgCl/Ag)
正确答案:(1)>(4)>(2)>(3) -
第6题:
采用控制电位库伦法在0.2mol/LKNO3介质中测定Br-时,控制工作电极电位为0,反应为Br-+Ag=AgBr+e,应选用的工作电极为()
- A、铂
- B、金
- C、银
- D、汞
- E、银-溴化银
正确答案:C -
第7题:
银-氯化银电极的电极电位决定于溶液中()
- A、Ag+浓度
- B、AgCl浓度
- C、Ag+和AgCl浓度和
- D、Cl-活度
正确答案:D -
第8题:
在含有Cl-、Br-、I-、CrO42-离子的浓度均为0.012mol.L-1的混合溶液中,逐渐加入AgNO3溶液使离子产生沉淀,沉淀析出的先后次序为()(已知AgCl、AgBr、AgI、Ag2CrO4的溶度积分别为1.8×10-10、5.0×10-13、8.3×10-17、1.2×10-12)
- A、AgCl、AgBr、AgI、Ag2CrO4
- B、Ag2CrO4、AgI、AgBr、AgCl
- C、Ag2CrO4、AgBr、AgI、AgCl
- D、AgI、AgBr、AgCl、Ag2CrO4
正确答案:D -
第9题:
下列电对中,φΘ最大者是()
- A、φΘ(AgCl/Ag)
- B、φΘ(AgI/Ag)
- C、φΘ(Ag+/Ag)
- D、(AgBr/Ag)
正确答案:C -
第10题:
已知AgCl、AgBr、Ag2CrO2-4的溶度积分别为1.8×10-10、5.2×10-13、3.4×10-11,某溶液中含有Cl-、Br-、CrO2-4的浓度均为0.01mol·L-1,向该溶液逐滴加入0.01mol·L-1AgNO3溶液时,最先和最后产生沉淀的分别是()。
- A、AgBr和Ag2CrO4
- B、AgBr和AgCl
- C、Ag2CrO4和AgCl
- D、Ag2CrO4和AgBr
正确答案:A -
第11题:
下列电对中,Eθ值最小的是()
- A、Ag+/Ag
- B、AgCl/Ag
- C、AgBr/Ag
- D、AgI/Ag
正确答案:D -
第12题:
电池(1)Ag|AgBr(s)|KBr(aq)|Br2|Pt,电池(2)Ag|AgNO3(aq)||KBr(aq)|AgBr(s)|Ag的电池电动势E1、E2都与Br-浓度无关。
正确答案:错误 -
第13题:
在298K时,下列反应的ΔrHθm等于AgBr(s)的ΔrHθm的为()。A、Ag+(aq)+Br-(aq)=AgBr(s)
B、2Ag(s)+Br2(l)=2AgBr(s)
C、Ag(s)+1/2Br-(g)=AgBr(s)
D、Ag(s)+1/2Br2(l)=AgBr(s)
参考答案:D
-
第14题:
pH值对电极电势有影响的是下列中哪个电对?
A. Sn4+/Sn2+ B. Cr2O72-/Cr3+ C. Ag+/Ag D.Br2/Br-答案:B解析:提示:有氢离子参加电极反应时,pH值对该电对的电极势有影响。它们的电极反应为:A. Sn4++2e-=Sn2+ B. Cr2O72-+14H++3e-=2Cr3++7H2O
C. Ag++e-=Ag D. Br2+2e- =2Br-。 -
第15题:
在标准条件下将氧化还原反应Fe2++Ag+Fe3++Ag装配成原电池,原电池符号为()
- A、(-)Fe2+|Fe3+‖Ag+½Ag(+)
- B、(-)Ag|Ag+‖Fe3+½Fe2+(+)
- C、(-)Pt|Fe2+,Fe3+‖Ag+½Ag(+)
- D、(-)Ag|Ag+‖Fe2+,Fe3+½Pt(+)
正确答案:C -
第16题:
下列反应中哪个是表示△H=△H(AgBr,s)的反应()
- A、Ag(aq)+Br(aq)AgBr(s)
- B、2Ag(s)+Br2(g)2AgBr(s)
- C、Ag(s)+Br2(l)AgBr(s)
- D、Ag(s)+Br2(g)AgBr(s)
正确答案:C -
第17题:
已知下述电池的电动势为0.18V.已知:φ°(Ag+/Ag)=0.7996V φ°(Cu2+/Cu)=0.34V. 试计算AgBr的Ksp。(-)Ag│AgBr([Br]=0.1mol/L)‖Cu2+(0.1mol/L)│Cu (+)
正确答案:Ksp(AgBr)=1.57×10-12 [已知:φ°(Ag+/Ag)=0.7996V φ°(Cu2+/Cu)=0.34V] -
第18题:
下列电对中标准电极电势最大的是哪个?()
- A、AgCl/Ag
- B、AgBr/Ag
- C、AgI/Ag
- D、Ag+/Ag
正确答案:D -
第19题:
在下列难溶银盐的饱和溶液中,Ag+离子浓度最大的是(括号内为溶度积)()
- A、AgCl(1.8×10-10)
- B、Ag2C2O4(3.4×10-11)
- C、AgCrO4(1.1×10-12)
- D、AgBr(5.2×10-13)
正确答案:B -
第20题:
下列电对中,电极电位值最大的是:()
- A、E°(Ag+/Ag)
- B、E°(AgI/Ag)
- C、E°(Ag(CN)2-/Ag)
- D、E°(Ag(NH3)2+/Ag)
正确答案:A -
第21题:
已知Kθsp(AgCl)〉Kθsp(AgBr)〉Kθsp(AgI),则下列电对中电极电位最高的是()(标准状态下)
- A、Ag+/Ag
- B、AgCl/Ag
- C、AgBr/Ag
- D、AgI/Ag
正确答案:A -
第22题:
在含有NH3的Ag+溶液中,用银离子选择电极直接电位法测得的离子活度为()
- A、Ag+的总浓度
- B、游离Ag(NH3)+的活度
- C、游离Ag+的活
- D、游离Ag(NH3)2+的活度
正确答案:C -
第23题:
某原电池的一个半电池是由金属银片浸在1.0mol·L-1Ag+溶液中组成的,另一半是由银片浸在C(Br-)为1.0mol·L-1的AgBr饱和溶液中组成的,后者为负极,测得电池电动势为0.728V。计算EΘ(AgBr/Ag)=(),KspΘ(AgBr)=()。
正确答案:0.0716V;4.6×10-13 -
第24题:
单选题在含有NH3的Ag+溶液中,用银离子选择电极直接电位法测得的离子活度为()AAg+的总浓度
B游离Ag(NH3)+的活度
C游离Ag+的活
D游离Ag(NH3)2+的活度
正确答案: C解析: 暂无解析
