亚硝酸盐在溶解氧充分的条件下可以生产( )A.一氧化二氮或氮气B.二氧化氮C.一氧化氮D.硝酸盐E.其他物质正确
题目
亚硝酸盐在溶解氧充分的条件下可以生产( )
A.一氧化二氮或氮气
B.二氧化氮
C.一氧化氮
D.硝酸盐
E.其他物质
正确
相似考题
更多“亚硝酸盐在溶解氧充分的条件下可以生产( )A.一氧化二氮或氮气B.二氧化氮C.一氧化氮D.硝酸盐 ”相关问题
-
第1题:
卫生人员欲对某河流进行水质监测,测定指标包括氨氮、亚硝酸盐氮、硝酸盐氮、溶解氧、化学耗氧量、生化需氧量、电导率、氧化还原电位等。采样时需在水样中加硫酸作为保存剂的测定指标是
A.氨氮、溶解氧
B.溶解氧
C.亚硝酸盐氮、溶解氧
D.溶解氧、化学耗氧量、生化需氧量
E.氨氮、亚硝酸盐氮、硝酸盐氮答案:E解析:河流水质监测是环境卫生的一项经常性工作。其采样量、水样的保存是水样采集的必然遇到的问题。这三道题是考查实际工作知识水平。1题:测定溶解氧、化学耗氧量、生化需氧量是不需要加保存剂的,而测定氨氮、亚硝酸盐氮、硝酸盐氮需要在水样中硫酸作为保存剂。备选答案中除了E,其他选项都不完全符合。2题:测定氨氮时,水样需要在4℃左右保存,以抑制微生物的活动,减缓物理作用和化学作用的速度。备选答案中除了E,其他选项都不需要在4℃左右保存。3题:测定项目不同对水样量有不同的要求。测定亚硝酸盐为50ml。备选答案中除了A,其他选项都不符合这一要求。
-
第2题:
厌氧氨氧化(ANAMMOX)作用是指( )。A.在厌氧条件下由厌氧氨氧化菌利用硝酸盐为电子受体,将氨氮氧化为氮气的生物反应过程
B.在厌氧条件下硝酸盐与亚硝酸盐反应生成氮气的过程
C.在厌氧条件下由厌氧氨氧化菌利用亚硝酸盐为电子受体,将氨氮氧化为氮气的生物反应过程
D.在缺氧条件下反硝化菌以硝酸盐作为电子受体,还原硝酸盐为氮气的过程答案:C解析:厌氧氨氧化作用,即以NO2--N为电子受体,将氨氮转化为氮气的生物反应。Strous等根据化学计量和物料衡算估算出ANAMMOX总的反应式为: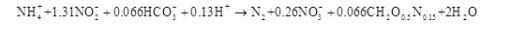
-
第3题:
嫌气条件下,硝酸盐在反硝化微生物的作用下,可以还原成
A.氮气
B.一氧化二氮
C.一氧化氮
D.氨气
D -
第4题:
阅读下列三段材料.根据要求完成任务。
材料一《普通高中化学课程标准(实验)》关于“二氧化氮和一氧化氮”的内容标准是:通过实验了解氯、氮、硫、硅等非金属及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响。
材料二某版本高中实验教科书《化学l》“二氧化氮和一氧化氮”的部分内容:
二、二氧化氮和一氧化氮
氮气占空气体积的五分之四左右。在通常情况下,氮气与氧气不发生反应,但在放电条件下,它们却可以直接化合,生成无色的一氧化氮(NO)。此外,在高温条件下,氮气也能与氧气反应生成一氧化氮.
一氧化氮不溶于水.在常温下很容易与空气中的氧气化合,生成二氧化氮(N02)。
二氧化氮是红棕色、有刺激性气味的有毒气体,密度比空气的大,易液化,易溶于水。因此,在闪电时,大气中常有少量N02产生,并随雨水落下。
材料三教学对象为高中一年级学生.他们已经学习了“金属及其化合物”“无机非金属材料的主角——硅”和“富集在海水中的元素——氯”等知识。
要求:
(1)完成材料二中的装置设计图,并填写表格。
(2)完成“二氧化氮和一氧化氮”的教学设计,内容包括教学目标和教学过程。答案:解析: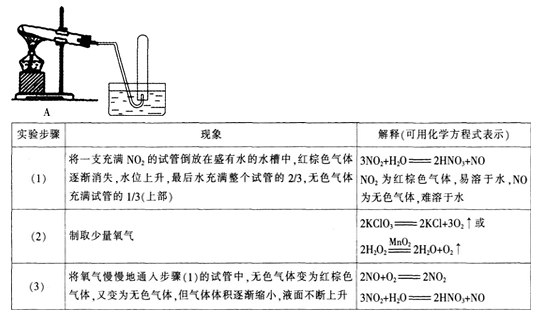
(2)教学目标
知识与技能:初步掌握一氧化氮和二氧化氮的重要性质,实验探究由二氧化氮制硝酸的可能方法;培养观察能力、信息处理能力。
过程与方法:会对有关物质的性质进行分析、归纳。
情感态度与价值观:了解氮氧化物对环境的污染.增强环保意识;通过酸雨利弊两方面的分析.形成辩证唯物主义观点。
教学过程
【引入】上节课我们学习了S02所形成的硫酸型酸雨的形成过程,在你们查阅资料的过程
中,形成酸雨的污染源除了S02,还有其他吗?
【学生】氮氧化物
【教师】氮氧化物同样不是空气的成分,那么它的来源在哪里呢?
【投影】二氧化氮和一氧化氮
1.氮氧化物的天然排放源:闪电,高空雨云闪电,有很强的能量,能使空气中的氮气和氧气部分化合,生成N0。继而在对流层中被氧化为N02,N02即为N0和N02之和:土壤硝酸盐分解,即使是未施过肥的土壤也含有微量
的硝酸盐,在土壤细菌的帮助下可分解出N0、N02和N20等气体。
氮氧化物的人为排放源:酸性物质N0x人为排放源主要是交通运输,如汽车尾气、飞机高空飞行等。
【教师】自然界的闪电和人为的汽车尾气产生氮氧化物的原理是一样的,都是在放电的条件下,使空气中的O2和N2反应。
【实验】模拟N0的形成
操作步骤:
①将氮气和氧气按l:1的比例混合经容器A.用浓硫酸干燥后进人反应器B。
②使8反应器中两电极放电间隙保持在2~3 cm,并接通高压直流电源。电压约为10kV.使混合气在电弧高温中强热五分钟左右。
③再从E处与抽气机连接,缓慢抽气,同时由F处向容器D输入纯氧气。【
现象】B和C处气体无色,容器D处看到有红棕色气体生成。
2.物理性质
【推进】上节课我们学习了S02可溶于水并能与水发生化学反应,那么N02的水溶性又如何呢?
【实验】向一小集气瓶的N02气体中滴人几滴水,振荡,观察现象。
【现象】红棕色消失。
【结论】N02能溶于水。
【教师】那么N0:有没有与水反应呢?
【实验】打开玻璃片,观察现象。向溶液中滴加几滴紫色石蕊试液,观察现象。
【现象】气体变成红棕色,溶液变红色。
【教师】请根据现象判断生成物是什么?写出化学方程式。
3.硝酸型酸雨的形成
【教师】空气中的O2和N2就是通过这样的过程形成硝酸型酸雨的。同样,工业上也利用这一原理制取硝酸
【教师】利用这一原理制硝酸,我们会发现按这样的方案进行的话,会生成N0,不但降低了原料的利用率,排放到空气中还会造成污染。如何才能做到物尽其用呢?
【讨论】第79页科学探究。
【教师】用实物投影投出设计方案,公布学生设计的最优方案。
【过渡】氮氧化物除了可以制成硝酸外,还有其他的用途。
【学生】阅读第79页和第80页的科学视野。
【教师】通过这两节课的学习,我们认识到S02和N02对大气的污染,那么你对酸雨又了解多少呢?
【投影】二氧化硫和二氧化氮对大气的污染
【学生】阅读第80~81页
【教师】对于防治酸雨,你还有没有其他的措施呢?从实际出发,我们可以用哪些具体的行动来防止酸雨?
【学生】讨论
【教师】上节课我们讲过凡事都有利弊两面,那么酸雨是不是没有任何好处,是一个例外吗?
【学生】讨论酸雨有什么有利之处?
【教师】任何事物都有利弊,酸雨也不例外。生态系统是个复杂的系统,某个部分可能受害,某个部分可能受益。目前,人们对酸雨给予生态环境的影响的认识是:总体来看是有害的,但在局部地区可能是有益的。我国碱性土壤占总土壤面积一半以上,适当的酸性降水对碱性土壤的作物在一定生长时间内有益。含有较多量硫酸根离子的雨水,对贫硫土壤补硫无疑有益,因为硫也是作物良性生长所必需的元素。凡事忌走向极端,弊大于利,是目前对酸雨的总体看法。我国湖北省兴山、当阳、郧县、襄樊、沙市、崇阳和罗田等地,经土壤化学分析均缺硫,土壤有效硫含量相当低。而硫是排在氮、磷、钾之后的作物所需的第四种主要营养元素。含硫降水无疑是补给农作物有效硫营养的途径之一.从而带来有利生态影响。某些蔬菜,如越冬作物油菜,需硫量较大。酸性降水对其更为有利。
四川省成都市温江区的土壤约有十二种.其中十种土壤有效硫含量偏低,证明缺硫。分析结果表明,小麦、水稻和油菜的茎秆和籽粒缺硫,缺硫导致产量降低。酸雨含有较多的硫酸根,可以补充部分土壤所缺的硫。但因缺硫过多,光靠酸雨还是不够的,应施含硫化肥。
酸雨中除了含硫酸根之外.还含有铵离子和硝酸根。它们的沉降在短期内不会给土壤造成酸化影响.反而对大多数不同类型的土壤都是有利的。但是长时间沉降,可引起土壤酸化,有负面效应。森林又当别论,农田有施肥之利,森林则无施肥之福,因而硝酸根的沉降对森林来说实际上是起施肥作用,起正面效应。
【投影】动画演示“雷雨发庄稼”。【随堂练习】第83页习题。 -
第5题:
4、笑气的主要成分是什么?
A.氮气
B.一氧化氮
C.氦气
D.一氧化二氮
NO₂
