已知有如下几种pH最简公式(1)一元弱酸(2)一元弱碱(3)两性物质(4)缓冲溶液 等浓度的HAc和NaOH,反应体积为2:1,应用公式________计算。
题目
已知有如下几种pH最简公式(1)一元弱酸(2)一元弱碱(3)两性物质(4)缓冲溶液 等浓度的HAc和NaOH,反应体积为2:1,应用公式________计算。
相似考题
更多“已知有如下几种pH最简公式(1)一元弱酸(2)一元弱碱(3)两性物质(4)缓冲溶液 等浓度的HAc和NaOH,反应体积为2:1,应用公式________计算。”相关问题
-
第1题:
用同一NaOH溶液分别滴定容积相等的H2SO4和HAC溶液,消耗的容积相等.说明H2SO4和HAC两溶液中的( )。
A.氢离子浓度(单位:mol/L下同)相等
B.H2SO4和HAC的浓度相等
C.H2SO4的浓度为HAC的浓度的1/2
D.H2SO4和HAC的电离度相等
E.两个滴定的PH突跃范围相同
正确答案:C
-
第2题:
一元弱酸溶液酸度的计算公式是[H+]=√cKa。()此题为判断题(对,错)。
参考答案:正确
-
第3题:
铬黑T是()
- A、一元弱碱
- B、二元弱碱
- C、一元弱酸
- D、二元弱酸
正确答案:D -
第4题:
用一定浓度的确NaOH滴定某一元弱酸时,滴定曲线图上滴定突跃的大小与该一元弱酸的()和()有关。
正确答案:浓度;Ka -
第5题:
某一元弱酸,浓度为0.1mol·L-1,该溶液的pH=5.15,该一元弱酸的Ka值是()。
- A、5×10-10
- B、4×10-10
- C、5×10-9
- D、4×10-9
正确答案:A -
第6题:
浓度为0.01 mol·L–1的一元弱碱(KbΘ=1.0×10–8),其pH=()。
正确答案:9.0 -
第7题:
已知0.1mol/L某一元弱酸的PH值为3,该弱酸溶液的电离度是:()
- A、0.01%
- B、3%
- C、1%
- D、0.1%
- E、以上都不对
正确答案:C -
第8题:
NaHCO3水溶液中氢离子浓度的计算公式为(),HAc-NaAc缓冲溶液氢离子浓度的计算公式为()。
正确答案:[H+]=Ka1·K;[H+]=Ka·C酸/C盐 -
第9题:
HAc-NaAc缓冲溶液的计算公式为()。
- A、[H+]=KaC酸/C盐
- B、[H+]=C·Ka
- C、[H+]=Ka1·Ka2
正确答案:A -
第10题:
用同一NaOH溶液分别滴定体积相等的H2SO4和HAc溶液,消耗的体积相等,说明H2SO4和HAc两溶液中的()
- A、氢离子浓度相等
- B、H2SO4和HAc的浓度相等
- C、H2SO4的浓度为HAc浓度的1/2
- D、两个滴定的pH突跃范围相同
正确答案:C -
第11题:
某一元弱酸与36.12mL0.100mol·L-1NaOH正好作用完全。然后再加入18.06mL0.100mol·L-1HCl溶液,测得溶液pH=4.92。计算该弱酸的解离常数是()。
正确答案:1.2×10-5 -
第12题:
填空题用一定浓度的确NaOH滴定某一元弱酸时,滴定曲线图上滴定突跃的大小与该一元弱酸的()和()有关。正确答案: 浓度,Ka解析: 暂无解析 -
第13题:
HAc-NaAc缓冲溶液pH值的计算公式为( )
A.

B.

C.

D.
 正确答案:B
正确答案:B
-
第14题:
已知某一元弱酸的浓度为c,用等体积的水稀释后,溶液的c(H+)浓度为()A.c/2
B.
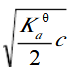
C.
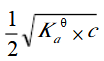
D.
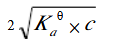 参考答案:B
参考答案:B
-
第15题:
下列()溶液是PH缓冲溶液。
- A、1摩尔/升HAc+1摩尔/升NaAc
- B、1摩尔/升HAc+1摩尔/升NaCl
- C、1摩尔/升HaC+1摩尔/升NaOH
正确答案:A -
第16题:
一元弱酸弱碱盐水溶液的酸度与溶液的浓度无关,这是由于弱酸弱碱盐()
- A、在水中不电离
- B、Ka和K相差不太大
- C、Ka和K相等
- D、是一种最好的缓冲溶液
正确答案:B -
第17题:
用0.1mol·L-1NaOH溶液分别与HCl和HAc溶液各20ml反应时,均消耗掉20ml的NaOH,这表示()。
- A、HCl和HAc溶液中,H+浓度相等
- B、HCl和HAc溶液的物质的量浓度相等
- C、HCl和HAc溶液的pH相等
- D、HCl和HAc的质量浓度相等
正确答案:B -
第18题:
已知:KNH3·H2O1.8×10-5,如用NH3·H2O和NH4Cl配成缓冲溶液,其缓冲作用的pH值范围是(),计算公式为()
正确答案:8.26-----10.26;pH=14-(pKb±1) -
第19题:
某二元弱酸,当C/Ka1≥()时,Ka1/Ka2>()时,可按一元弱酸公式计算。
正确答案:500;104 -
第20题:
用同一NaOH溶液,分别滴定容积相等的H2SO4和HAc溶液,消耗的容积相等,这说明H2SO4和HAc两溶液中的()。
- A、氢离子浓度相等(单位:mol/l)
- B、H2SO4和HAc的浓度相等
- C、H2SO4的浓度为HAc浓度为1/2
- D、H2SO4和HAc的电离度相等
- E、两个滴定的pH突跃范围相同
正确答案:C -
第21题:
试用HAc和NaAc设计一缓冲溶液,其pH值为: (1)4.00; (2)5.00, 问HAc及NaAc的浓度各为多少?假定酸与盐的总浓度为1.0mol•L-1。(已知Ka=1.76×10-5)
正确答案: (1)HAc:NaAc=0.85:0.15;
(2)HAc:NaAc=0.36:0.64 -
第22题:
H3PO4的pKa1,pKa2,pKa3分别是2.12,7.20,12.40,欲用H3PO4和NaOH配制pH=7.20的缓冲溶液时,应使用H3PO4和NaOH的物质的量之比为:()
- A、1:2
- B、2:3
- C、3:2
- D、1:1
正确答案:D -
第23题:
H3PO4的pKa1,pKa2,pKa3分别是2.12,7.20,12.40,欲用H3PO4和NaOH配制pH=2.12的缓冲溶液时,应使用H3PO4和NaOH的物质的量之比为:()
- A、1:1
- B、1:2
- C、2:1
- D、2:3
正确答案:C -
第24题:
单选题用同一NaOH溶液分别滴定体积相等的H2SO4和HAc溶液,消耗的体积相等,说明H2SO4和HAc两溶液中的()A氢离子浓度相等
BH2SO4和HAc的浓度相等
CH2SO4的浓度为HAc浓度的1/2
D两个滴定的pH突跃范围相同
正确答案: A解析: 暂无解析
