用于比较同一药物两种剂型的生物等效性的药代动力学参数是A.AUC、V和CB.AUC、V和TC.AUC、V和tD.AUC、C和TE.AUC、K和t
题目
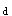 和C
和C
B.AUC、V
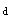 和T
和T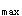
C.AUC、V
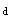 和t
和t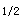
D.AUC、C
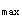 和T
和T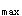
E.AUC、K和t
相似考题
更多“用于比较同一药物两种剂型的生物等效性的药代动力学参数是”相关问题
-
第1题:
药物的临床研究包括了
A.临床试验
B.生物等效性试验
C.临床试验和生物等效性试验
D.药理、毒理试验
E.动物药代动力学试验
正确答案:C
-
第2题:
新药的临床研究内容不包括A、药物耐受性试验
B、药物急性毒性试验
C、生物等效性试验
D、药物上市后再评价
E、药代动力学
参考答案:B
-
第3题:
以药动学参数为指标,比较同一种药物相同或者不同剂型的制剂,在相同的试验条件下,其活性成分吸收程度和速度有无统计学差异的人体试验是
A、Ⅰ期临床试验
B、Ⅱ期临床试验
C、Ⅲ期临床试验
D、Ⅳ期临床试验
E、生物等效性试验
参考答案:E
-
第4题:
用于评价药物等效性的药物动力学参数有A.生物半衰期(t1/2)
B.清除率(Cl)
C.血药峰浓度(Cmax)
D.表观分布容积(V)
E.血药浓度一时间曲线下的面积(AUC)答案:C,E解析:生物等效性:对药物动力学主要参数(AUC、Cmax)进行统计分析,可作出生物等效性评价。 -
第5题:
用于评价制剂生物等效性的药物动力学参数有A.生物半衰期(t1/2)
B.清除率(C1)
C.血药峰浓度(Cmax)
D.表观分布容积(V)
E.血药浓度一时间曲线下面积(AUC)答案:C,E解析: -
第6题:
关于生物等效性的说法,正确的是A.一般仿制药的研制需要进行生物等效性试验
B.以药代动力学参数为指标
C.是比较同一种药物的相同或者不同剂型的制剂,在相同的试验条件下,其活性成分吸收程度和速度有无统计学差异的人体试验
D.一般为18~24例答案:A,B,C,D解析:生物等效性试验,是指用生物利用度研究的方法,以药代动力学参数为指标,比较同一种药物的相同或者不同剂型的制剂,在相同的试验条件下,其活性成分吸收程度和速度有无统计学差异的人体试验。一般为18~24例。一般仿制药的研制需要进行生物等效性试验。 -
第7题:
两制剂含等量的相同活性成分,具有相同的剂型,符合同样的或可比较的质量标准()
- A、生物利用度
- B、生物等效性
- C、药学等效性
- D、稳态血药浓度
- E、治疗药物监测
正确答案:C -
第8题:
用于比较同一药物两种剂型的生物等效性的药代动力学参数是()
- A、AUC、Vd和Cmax
- B、AUC、Vd和Tmax
- C、AUC、Vd和t1/2
- D、AUC、Cmax和Tmax
- E、Cmax、Tmax和t1/2
正确答案:D -
第9题:
承担并参加Ⅰ期临床的生物等效性试验。提示:依据《中国药典》2005年版二部和《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》的要求下列有关叙述中,哪些是正确的()
- A、生物利用度是指剂型中的药物被吸收进入血液的速率和程度
- B、生物利用度是指一种药物的不同制剂在相同的试验条件下,给以相同的剂量,反映其吸收速率和程度的主要动力学参数没有明显的统计学差异
- C、生物等效性是指剂型中的药物被吸收进入血液的速率和程度
- D、生物等效性是指一种药物的不同制剂在相同的试验条件下,给以相同的剂量,反映其吸收速率和程度的主要动力学参数没有明显的统计学差异
- E、生物利用度有绝对生物利用度和相对生物利用度之分
- F、化学药品属注册分类6中的口服固体制剂应当进行生物等效性试验
正确答案:A,D,E,F -
第10题:
多选题用于评价制剂生物等效性的药物动力学参数有( )正确答案: C,E解析: -
第11题:
单选题生物等效性是指:A两种含同一有效成分的制剂,生物利用度不同
B两种剂型相同而含不同有效成分的药品,效应相同
C两种剂型相同而所含药物剂量不同的药物,作用相同
D两种剂型相同而含同一有效成分的药品,效应不同
E两种药学等同的药品,所含有效成分的生物利用度相同
正确答案: C解析: 暂无解析 -
第12题:
单选题用于比较同一药物两种剂型的生物等效性的药代动力学参数是( )。AAUC、Vd和Cmax
BAUC、Vd和T1/2
CAUC、Vd和t1/2
DAUC、Cmax和Tmax
EAUC、K和tl/2
正确答案: A解析: 暂无解析 -
第13题:
药物的临床前研究包括了( )
A.临床试验
B.生物等效性试验
C.临床试验和临床等效性试验
D.药理、毒理试验
E.动物药代动力学试验
正确答案:C
-
第14题:
药物临床研究包括的内容是
A.动物药代动力学试验
B.生物等效性试验和临床试验
C.临床试验
D.药物稳定性、药理和毒理
E.生物等效性试验
正确答案:B
-
第15题:
用于评价生物等效性的药物动力学参数有A.生物半衰期(t1/2)
B.清除率(Cl)
C.血药峰浓度(Cmax)
D.表观分布容积(V)
E.血药浓度一时间曲线下面积(AUC)答案:C,E解析:本题考查评价生物等效性的药动学参数。生物等效性的药动学参数有:血药峰浓度(Cmax)、血药浓度-时间曲线下面积(AUC)。 -
第16题:
用于评价制剂生物等效性的药物动力学参数有A.生物半衰期(t1/2)
B.清除率(Cl)
C.血药峰浓度(Cmax)
D.表观分布容积(V)
E.血药浓度一时间曲线下面积(AUC)答案:C,E解析:对药物动力学主要参数(如AUC、Cmax)进行统计分析,可做出生物等效性评价。 -
第17题:
生物等效性是指( )。A.两种含同一有效成分的制剂,生物利用度不同
B.两种剂型相同而含不同有效成分的药品,效应相同
C.两种剂型相同而所含药物剂量不同的药物,作用相同
D.两种剂型相同而含同一有效成分的药品,效应不同
E.两种药学等效的制剂,所含有效成分的生物利用度相同答案:E解析:生物等效性(BE)是指药学等效制剂或可替换药物在相同试验条件下,服用相同剂量,其活性成分吸收程度和速度无明显统计学差异。 -
第18题:
一种药物的不同制剂在相同试验条件下,给以相同剂量,反应其吸收程度和速度的主要药物动力学参数无统计学差异()
- A、生物利用度
- B、生物等效性
- C、药学等效性
- D、稳态血药浓度
- E、治疗药物监测
正确答案:B -
第19题:
SFDA推荐首选的生物等效性的评价方法为()
- A、药物动力学评价方法
- B、药效动力学评价方法
- C、体外研究法
- D、临床比较试验法
正确答案:A -
第20题:
注册分类3的新药应当进行()
- A、Ⅰ~Ⅳ期临床试验
- B、人体药代动力学研究和至少100对随机对照临床试验
- C、人体药代动力学研究
- D、生物等效性试验
- E、开放试验
正确答案:B -
第21题:
单选题以药动学参数为指标,比较同一种药物相同或者不同剂型的制剂,在相同的试验条件下,其活性成分吸收程度和速度有无统计学差异的人体试验是()AⅠ期临床试验
BⅡ期临床试验
CⅢ期临床试验
DⅣ期临床试验
E生物等效性试验
正确答案: E解析: 暂无解析 -
第22题:
单选题用于比较同一药物两种剂型的生物等效性的药代动力学参数是( )。AAUC、V和Cmax
BAUC、V和tmax
CAUC、V和t1/2
DAUC、Cmax和tmax
EAUC、tmax和t1/2
正确答案: A解析:
生物等效性是指一种药物的不同制剂在相同试验条件下,给以相同剂量,反映其吸收程度和速度的主要动力学参数无统计学差异。选择能描述血药浓度时间曲线特征的适宜药物动力学参数如血药浓度时间曲线下面积AUC、峰浓度Cmax和达峰时间tmax等,通过比较这些参数,判断两种剂型是否生物等效。 -
第23题:
单选题注册分类1的新药必须进行()AⅠ~Ⅳ期临床试验
B人体药代动力学研究和至少100对随机对照临床试验
C人体药代动力学研究
D生物等效性试验
E开放试验
正确答案: A解析: 暂无解析
