生成沉淀、()、生成难电离的物质是发生离子反应的条件。A.生成碱B.生成气体C.生成液体D.生成酸
题目
生成沉淀、()、生成难电离的物质是发生离子反应的条件。
A.生成碱
B.生成气体
C.生成液体
D.生成酸
相似考题
更多“生成沉淀、()、生成难电离的物质是发生离子反应的条件。A.生成碱B.生成气体C.生成液体D.生成酸 ”相关问题
-
第1题:
阿司匹林在潮湿空气中和较高温度条件下,可发生颜色变化,是因为( )A.阿司匹林在高温条件下被氧化
B.阿司匹林遇湿气水解生成水杨酸,水杨酸是有色物质
C.阿司匹林遇湿气水解生成醋酸,醋酸在高温下被氧化生成有色物质
D.阿司匹林遇湿气水解生成水杨酸,水杨酸在高温下被氧化生成有色物质
E.以上都不对答案:D解析: -
第2题:
不能使离子交换反应进行完全的是()。
A生成弱电解质
B生成沉淀
C物质完全电离成离子
D生成易挥发的物质
C
略 -
第3题:
向Co(OH)2沉淀、Ni(OH)2沉淀中加入3% H2O2溶液的实验现象分别是____。
A.生成褐色沉淀, 生成黑色沉淀
B.生成褐色沉淀,不反应
C.生成黑色沉淀 ,不反应
D.生成黑色沉淀,生成褐色沉淀
生成褐色沉淀,不反应 -
第4题:
高中化学《离子反应及其发生的条件》
一、考题回顾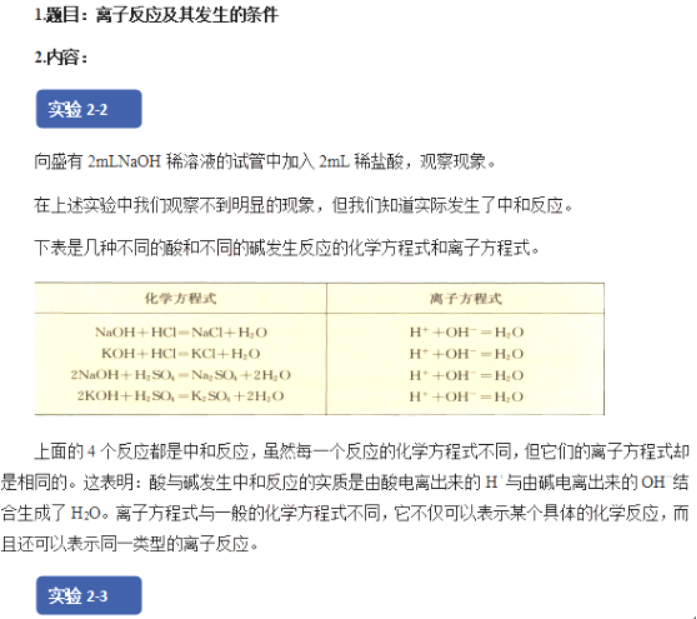
二、考题解析
【教学过程】
环节一:生活导入
【提出问题】根据我们上节课的学习,离子方程式如何书写?
【学生回答】“写、拆、删、查”。
【提出问题】哪些条件下可以发生离子反应?
【学生回答】在生成难溶物时可以发生,例如Na2SO4与BaCl2反应生成BaSO4沉淀。
【教师引导】今天我们就来探究还有哪些条件可以发生离子反应。
环节二:探究新知
【提出问题】根据之前所学及预习,猜想有哪些条件可以发生离子反应?
【学生回答】除难溶物之外还有水、气体参与反应或生成的条件下可发生离子反应。。
【教师引导】那今天我们就通过两组实验来探究有水、气体参与反应或生成的条件下是否能发生离子反应?
实验1:向盛有2mLNaOH溶液的试管中先滴加两滴酚酞,再滴加稀HCl,观察现象并思考原因?
【学生回答】溶液由红色变为无色,NaOH与HCl发生了离子反应生成了水。
【教师总结】NaOH电离出Na+和OH-,OH-使溶液显碱性,滴加酚酞指示剂后变红,滴加稀盐酸OH-和H+发生中和反应,即H++OH-=H2O,溶液又褪色,OH-和H+数目减少,Na+和C1-数目没有发生变化。说明在有水生成的条件下可以发生离子反应,离子反应式为:H++OH-=H2O。
【教师引导】我们通过实验已经证明了在有难溶物、水参与的条件下可以发生离子反应,有气体参与的反应又该如何验证呢?
【学生回答】用Na2CO3和HCl反应生成CO2来验证。
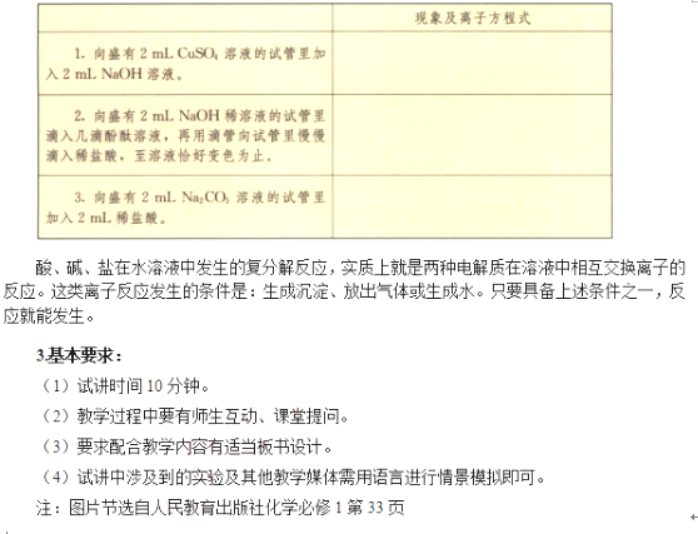
【学生操作】实验2:向盛有2mLNa2CO3溶液的试管中加入2mLHCl溶液。
【描述现象】溶液中有气泡产生,发生了离子反应。
【教师总结】Na2CO3电离出Na+和CO32-,滴加稀盐酸后CO32-和H+反应生成H2O和CO2,即
CO32-+H+=H2O+CO2↑,CO32-和H+数目减少,Na+和Cl-数目没有发生变化。
【教师总结】酸、碱、盐在水溶液中发生的复分解反应,实质上就是两种电解质在溶液中相互交换离子的反应。这类离子反应发生的条件是:生成沉淀、放出气体或生成水。只要具备上述条件之一,反应就能发生。
环节三:拓展提升
【媒体展示】已知离子反应发生的条件是:生成沉淀、放出气体或生成水,那接下来大家来判断多媒体上的着几组物质能否发生离子反应?(PPT)。
【学生回答】1.NaOH与H2SO4(可以)
2.NaCl与H2SO4(不可以)
3.AgNO3与NaCl(可以)
(四)小结作业
学生总结归纳本节课所学主要知识,表述学习心得。
作业:课下总结酸、碱、盐发生的离子反应方程式。
板书设计略答案:解析: -
第5题:
向Co(OH)2沉淀、Ni(OH)2沉淀中加入3% H2O2溶液的实验现象分别是____________。
A.生成褐色沉淀, 生成黑色沉淀 ;
B.生成褐色沉淀,不反应
C.生成黑色沉淀 ,不反应
D.生成黑色沉淀,生成褐色沉淀
生成褐色沉淀,不反应
