MnO4-滴定C2O42-时,开始反应进行缓慢,MnO4-不易褪色,但一旦有少量Mn2+生成,反应速度就迅速加快,这种现象称为()。A.催化作用B.诱导反应C.分解作用D.自动催化作用
题目
MnO4-滴定C2O42-时,开始反应进行缓慢,MnO4-不易褪色,但一旦有少量Mn2+生成,反应速度就迅速加快,这种现象称为()。
A.催化作用
B.诱导反应
C.分解作用
D.自动催化作用
相似考题
更多“MnO4-滴定C2O42-时,开始反应进行缓慢,MnO4-不易褪色,但一旦有少量Mn2+生成,反应速度就迅速加快,这种现象称为()。”相关问题
-
第1题:
已知E?(Fe3+/Fe2+)=0.77V,E?(MnO4-/Mn2+)=1.51V,当同时提高两电对电极的酸度时,两电对电极电势数值的变化是( )。
A.E?(Fe3+/Fe2+)变小,E?(MnO4-/Mn2+)变大
B.E?(Fe3+/Fe2+)变大,E?(MnO4-/Mn2+)变大
C.E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)变大
D.E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)不变答案:C解析:电极电势与物质的本性、物质的浓度、温度有关,一般温度的影响较小。Fe3++e_=Fe2+,与H+浓度无关;MnO4-+8H++5e_=Mn2++4H2O,H+参与了该反应。因此,E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)变大。 -
第2题:
亚硝酸钠滴定法中,加KBr是为了A.添加Br
B.抑制反应进行
C.生成Br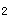
D.生成NO ·Br
·Br ,加快反应速度
,加快反应速度
E.生成HBr答案:D解析: -
第3题:
其他条件不变时,能使电对MnO4-/Mn2+的电极电位增大的方法是()
- A、增大pH
- B、降低pH
- C、增大Mn2+浓度
- D、前三个都可以
正确答案:B -
第4题:
用Na2C2O4标定高锰酸钾时,刚开始时褪色较慢,但之后褪色变快的原因是()。
- A、温度过低
- B、反应进行后,温度升高
- C、MN2+催化作用
- D、高锰酸钾浓度变小
正确答案:C -
第5题:
已知298K时φΘ(H2O2/H2O)=1.77V,φΘ(MnO4-/Mn2+)=1.51V,则H2O2的氧化能力大于MnO4-,因此MnO4-不能氧化H2O2。
正确答案:错误 -
第6题:
高锰酸钾滴定过氧化氢时,开始高锰酸钾褪色很慢,后来逐渐变快其原因是()
- A、滴定过程中,消耗H+,使反应加快
- B、滴定过程中,产生消耗H+,使是反应加快
- C、滴定过程中,反应物浓度越来越小,是反应加快
- D、反应生成Mn2+,它是反应的催化剂
正确答案:D -
第7题:
MnO4-与Fe2+反应的平衡常数()。已知jθ(MnO4-/Mn2+)=1.51V,jθ(Fe3+/Fe2+)=0.77V
- A、3.4×1012
- B、320
- C、3.0×1062
- D、4.2×1053
正确答案:C -
第8题:
KMnO4滴定H2O2,开始时KMnO4褪色很慢,后来逐渐变快,其原因是()。
- A、滴定过程中,消耗H+离子,使反应速度加快
- B、滴定过程中,产生H+离子,使反应速度加快
- C、滴定过程中,反应物浓度越来越小,使反应速度加快
- D、反应产生Mn2+,它是KMnO4与H2O2反应的催化剂
正确答案:D -
第9题:
KMnO4滴定Na2C2O4时,第一滴KMnO4溶液的褪色最慢,但以后就变快,原因是:( )
- A、反应产生Mn2+,它是KMnO4与Na2C2O4反应的催化剂
- B、该反应是分步进行的,要完成各步反应需一定时间
- C、当第一滴KMnO4与Na2C2O4反应后,产生反应热,加快反应速度
- D、KMnO4电位很高,干扰多,影响反应速度反应产生Mn2+,它是KMnO4与Na2C2O4反应的催化剂
正确答案:A -
第10题:
KMnO4滴定C2O42-时,反应速度由慢到快,这种现象称作:()
- A、催化反应
- B、自动催化反应
- C、诱导反应
- D、副反应
正确答案:B -
第11题:
下列现象各是什么反应?(填A,B,C,D) (1)MnO4-滴定Fe2+时,Cl-的氧化被加快() (2)MnO4-滴定C2O42-时,速度由慢到快() (3)Ag+存在时,Mn2+氧化成MnO4() (4)PbSO4沉淀随H2SO4浓度增大溶解度增加() (A)催化反应 (B)自动催化反应 (C)副反应 (D)诱导反应
正确答案:D;B;A;C -
第12题:
单选题Ag+离子存在时,Mn2+被S2O82-氧化为MnO4-属于什么反应()。A催化反应
B自动催化反应
C副反应
D诱导反应
正确答案: B解析: 暂无解析 -
第13题:
由电对MnO4-/Mn2+和电对Fe3+/Fe2+组成原电池,已知φ MnO4-/Mn2+,φ Fe3+/Fe2+,
则电池反应的产物为:
A. Fe3+和Mn2+ B. MnO4-和Fe3+ C. Mn2+和Fe2+ D. MnO4-和Fe2+答案:A解析:提示:电极电势高的电对作正极,电极电势低的电对作负极。正极发生的电极反应是氧化剂的还原反应,负极发生的是还原剂的氧化反应。即
MnO4-+8H++5e-=Mn2++4H2O
Fe2+-e-=Fe3+ -
第14题:
含Cl-介质中,用KMnO4法测定Fe2+,加入MnSO4的主要目的是( )。
A. 抑制MnO4-氧化Cl-的副反应发生
B. 作为滴定反应的指示剂
C. 增大滴定的突跃区间
D. 同时测定Mn2+和Fe2+答案:A解析:用KMnO4法滴定Fe2+时,若有Cl-存在,MnO-4和Cl-发生反应,将使KMnO4溶液消耗量增加,而使测定结果产生误差。此时,在溶液中加MnSO4,可防止Cl-对MnO-4的还原作用,能获得准确的滴定结果。 -
第15题:
在酸性介质中,用KMnO4溶液滴定应()。
- A、像酸碱滴定那样快进行
- B、在开始时缓慢进行以后逐渐加快
- C、开始加快,然后缓慢
- D、在近化学计量点时加快进行
正确答案:B -
第16题:
对于EA(MnO4-/Mn2+)来说,下列叙述中正确的是()。
- A、Mn2+浓度增大则E值增大
- B、H+浓度的变化对E的影响比Mn2+浓度变化的影响大
- C、溶液稀释,c(MnO4-)/c(Mn2+)值不变,E值也不改变
- D、MnO4-浓度减小,E值增大
正确答案:B -
第17题:
将MN2+氧化成MnO4-后进行比色测定时,其相应氧化剂应选择过二硫酸氨。
正确答案:正确 -
第18题:
在酸性介质中,用KMnO4溶液滴定草酸盐,滴定应()。
- A、象酸碱滴定那样快进行
- B、在开始时缓慢进行以后逐渐加快
- C、开始时快,然后缓慢
- D、在近化学计量点时加快进行
正确答案:B -
第19题:
标定KMnO4时,第1滴加入没有褪色以前,不能加入第2滴,加入几滴后,方可加快滴定速度原因是()。
- A、KMnO4自身是指示剂,待有足够KMnO4时才能加快滴定速度
- B、O2为该反应催化剂,待有足够氧时才能加快滴定速度
- C、Mn2+为该反应催化剂,待有足够Mn2+才能加快滴定速度
- D、MnO2为该反应催化剂,待有足够MnO2才能加快滴定速度
正确答案:C -
第20题:
写出电对φθMnO4-/Mn2+,φθCr2O72-/Cr3+φθI2/I-的电极电位大小的排列的顺序。
正确答案:φθMnO4-/Mn2+>φθCr2O72-/Cr3+>φθI2/I- -
第21题:
MnO4-、MnO42-、MnO2、Mn3+、Mn2+在酸性介质中易发生歧化反应的是()、(),MnO42-、Mn2+的颜色依次是()、()
正确答案:MnO42-;Mn3+;绿色;肉色 -
第22题:
在酸性介质中,用KMnO4溶液滴定草酸盐,滴定应()
- A、像酸碱滴定那样快速进行;
- B、在开始时缓慢进行,以后逐渐加快;
- C、始终缓慢地进行;
- D、开始时快,然后缓慢;
- E、在近化学计量点时加快进行。
正确答案:B -
第23题:
单选题KMnO4滴定C2O42-时,反应速度由慢到快,这种现象称作:()A催化反应
B自动催化反应
C诱导反应
D副反应
正确答案: D解析: 暂无解析 -
第24题:
单选题已知Eϴ(Fe3+/Fe2+)=0.77V,Eϴ(MnO4-/Mn2+)=1.51V,当同时提高两电对电极的酸度时,两电对电极电势数值的变化是( )。[2019年真题]AEϴ(Fe3+/Fe2+)变小,Eϴ(MnO4-/Mn2+)变大
BEϴ(Fe3+/Fe2+)变大,Eϴ(MnO4-/Mn2+)变大
CEϴ(Fe3+/Fe2+)不变,Eϴ(MnO4-/Mn2+)变大
DEϴ(Fe3+/Fe2+)不变,Eϴ(MnO4-/Mn2+)不变
正确答案: B解析:
电极电势与物质的本性、物质的浓度、温度有关,一般温度的影响较小。Fe3++e_=Fe2+,与H+浓度无关;MnO4-+8H++5e_=Mn2++4H2O,H+参与了该反应。因此,Eϴ(Fe3+/Fe2+)不变,Eϴ(MnO4-/Mn2+)变大。
