问答题解释下列现象。 A.将氯水慢慢加入到含有Br-和I-的酸性溶液中,以CCl4萃取,CCl4层变为紫色。 B.EθI2/I-(0.534V)>EθCu2+/Cu+(0.159V),但是Cu2+却能将I-氧化为I2。 C.间接碘量法测定铜时,Fe3+和AsO43-都能氧化I-析出I2,因而干扰铜的测定,加入NH4HF2两者的干扰均可消除。 D.Fe2+的存在加速KmnO4氧化Cl-的反应。 E.以KmnO4滴定C2O42-时,滴入KmnO4的红色消失速度由慢到快。 F.于
题目
相似考题
更多“解释下列现象。 A.将氯水慢慢加入到含有Br-和I-的酸性溶液中,以CCl4萃取,CCl4层变为紫色。 B.”相关问题
-
第1题:
下列说法正确的是( )。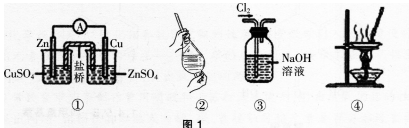
A.可用装置①构成锌铜原电池
B.可用装置②进行CCl4萃取碘水中碘的实验
C.可用装置③除去Cl2中含有的少量HCl
D.可用装置④蒸干FeCl3饱和溶液制备FeCl3晶体答案:B解析:铜锌原电池中,两个半电池的组成不匹配,锌和锌盐溶液组成锌半电池,铜和铜盐溶液组成铜半电池;②装置为分液漏斗,碘在四氯化碳中的溶解度大于在水中的溶解度,所以能用②装置进行四氯化碳萃取碘水中碘的实验;③中C12、HCl均能与NaOH溶液反应,不能用③装置除去Cl2中含有的HCl;用④装置蒸干FeCl3溶液时,Fe3+会水解生成Fe(OH)3,加热生成Fe203,不能得到FeCl3晶体。 -
第2题:
一溶液中含有相同浓度的Br-离子和I-离子,逐滴加入AgNO3溶液时,你能否从结构观点判断哪种物质先沉淀析出.简要说明理由
正确答案:由于Ag+是18电子外壳的阳离子,其极化力和变形性都很大,而I-的变形性比Br-大,所以AgI中相互极化作用比AgBr中大,故AgI先沉淀出来 -
第3题:
如何解释I2溶解在CCl4中是紫色,而溶解在碘化钾溶液中呈红棕色?
正确答案:I2在CCl4中呈紫色,与碘蒸气颜色相同,这表明I2处于单个分子状态,没有变形,也没有溶剂化;I2在KI溶剂中由于I-使I2极化变形,电子被激发时,吸收的波长变短,而呈现波长较长的红光。 -
第4题:
溶液中含有I-和Br-,当加入氯水时,()离子先和Cl2反应。已知φθCl2/Cl-=1.36V、φθBr2/Br-=1.07V、φθI2/I-=0.54V。
正确答案:I- -
第5题:
用30毫升CCL4萃取等体积水溶液中的I2,下列哪种方法最合理?()
- A、30毫升1次萃取
- B、10毫升分3次
- C、2毫升分15次
- D、3毫升分10次
正确答案:B -
第6题:
25℃时,Br2在CCl4和水中的分配比为29.0,取一定体积含溴水溶液用等体积的CCl4萃取2次后,集中2次的CCl4溶液,用等体积的纯水洗一次(反萃取),计算Br2的得率。
正确答案:Br2的得率为96.67% -
第7题:
CCl4难溶于水而C2H5OH易溶于水的原因不可能是()。
- A、水是极性分子(且有氢键)
- B、CCl4是非极性分子物质
- C、C2H5OH含有氢键,并能与水形成氢键
- D、CCl4是极性分子物质,能与水形成氢键
正确答案:D -
第8题:
某化合物A能溶于水,在溶液中加入K2SO4时有不溶于酸的白色沉淀B生成并得到溶液C。在溶液C中加入AgNO3不发生反应,但它可和I2反应,产生有刺激性气味的黄绿色气体D和溶液E。将气体D通入KI溶液中,有棕色溶液F生成。当加CCl4于溶液F中,在CCl4层中显紫红色,而水溶液中的颜色变浅。若在这水溶液中加入AgNO3,则有黄色沉淀G生成。写出A,B,C,D,E,F,G各是什么物质?
正确答案:A.Ba(ClO3)2
B.BaSO4
C.KClO3
D.Cl2
E.KIO3
F.KI3
G.AgI -
第9题:
AlCl3在气态或CCl4溶液中是()体,其中有()桥键
正确答案:双聚;氯 -
第10题:
单选题用CCl4萃取水中的甲苯,分层后,甲苯在()层溶液中。A上
B中
C上和下
D下
正确答案: D解析: 暂无解析 -
第11题:
单选题有一种含Cl-、Br-和I-的溶液,要使I-被氧化而Cl-、Br-不被氧化,则在以下常用的氧化剂中应选()最为适宜AKMnO4酸性溶液
BK2Cr2O7酸性溶液
C氯水
DFe2(SO4)2溶液
正确答案: C解析: 暂无解析 -
第12题:
单选题在酸性溶液中KBrO3与过量的KI反应,达到平衡时的溶液中( )A两电对BrO3-/Br-与I2/I-的电位相等
B电对BrO3-/Br-的电位大于电对I2/I-的电位
C反应产物I2与KBr的物质的量相等
D溶液中已绝无BrO3-离子存在
正确答案: D解析: 暂无解析 -
第13题:
鉴别溶液中的Cl-、Br-、I-,可以选用的试剂是( )。A.碘水、淀粉溶液
B.溴水、汽油
C.氯水、淀粉
D.硝酸银溶液、稀硝酸
E.溴水、四氯化碳答案:D解析: -
第14题:
下列区分苯和己烯的实验方法和判断正确的是()
- A、分别点燃,无黑烟生成的是苯
- B、分别加入溴水振荡,静置后分层,下层橙黄色消失的是己烯
- C、分别加入溴的CCl4溶液振荡,静置后分层,上下两层均为无色的是己烯
- D、分别加入酸性KMnO4溶液振荡,紫色消失的是己烯
正确答案:D -
第15题:
CCl4中C原子以()杂化,其分子的空间构型为()。
正确答案: 等性sp3杂化;正四面体 -
第16题:
已知φθI2/I-=0.54V,φθCl2/Cl-=1.36V,φθBr2/Br-=1.09V若将氯水加到含有Br-和I-的溶液中,所发生的反应是()。
- A、首先析出I2
- B、逸出氯气
- C、Br2先析出
- D、不发生反应
- E、I2和Br-同析出
正确答案:A -
第17题:
在酸性溶液中KBrO3与过量的KI反应,达到平衡时的溶液中( )
- A、两电对BrO3-/Br-与I2/I-的电位相等
- B、电对BrO3-/Br-的电位大于电对I2/I-的电位
- C、反应产物I2与KBr的物质的量相等
- D、溶液中已绝无BrO3-离子存在
正确答案:A -
第18题:
有一种含Cl-、Br-、I-和的溶液,要使I-被氧化,而Cl-、Br-不被氧化,在以常用的氧化剂中应选()为最适宜。
正确答案:Fe2(SO4)3溶液 -
第19题:
解释下列现象。 A.将氯水慢慢加入到含有Br-和I-的酸性溶液中,以CCl4萃取,CCl4层变为紫色。 B.EθI2/I-(0.534V)>EθCu2+/Cu+(0.159V),但是Cu2+却能将I-氧化为I2。 C.间接碘量法测定铜时,Fe3+和AsO43-都能氧化I-析出I2,因而干扰铜的测定,加入NH4HF2两者的干扰均可消除。 D.Fe2+的存在加速KmnO4氧化Cl-的反应。 E.以KmnO4滴定C2O42-时,滴入KmnO4的红色消失速度由慢到快。 F.于K2Cr2O7标准溶液中,加入过量KI,以淀粉为指示剂,用Na2S2O3溶液滴定至终点时,溶液由蓝变为绿。 G.以纯铜标定Na2S2O3溶液时,滴定到达终点后(蓝色消失)又返回到蓝色。
正确答案: A.Cl2+2I-=I2+Cl-,I2首先析出萃取进入CCl4层显紫色。
B.I-和Cu+生成CuI↓使[Cu+]变小,ECu2+/Cu+增大。
C.加入NH4HF2后,Fe3+与F-生成FeF6+,EθH3AsO4/H3AsO3=0.56V,EθI2/I-=0.53V,需要较大酸度才能氧化I-,NH4HF2起缓冲作用,使pH维持在3.0~4.0,此时不能氧化,故不干扰。
D.这是由于诱导反应所致。KMnO4氧化Fe2+的过程中形成了一系列的Mn的中间产物:Mn(VI),Mn(V),Mn(IV),Mn(III),它们均能氧化Cl-,因而加速了KmnO4氧化Cl-的反应。
E.反应本身速度慢,但反应生成的Mn2+对反应起催化作用,故反应加速,褪色快。
F.Cr2O72-与KI反应生成Cr3+、I2,I2与淀粉显蓝色,加入S2O32-至终点后,生成无色的的I-和S4O62-,故蓝色褪去,显Cr3+的绿色。
G.纯铜标定Na2S2O3的反应是:2Cu2++4I-=2CuI↓+I2,I2与粉显蓝色,滴定反应为:I2+2S2O32-=2I-+S4O62-,终点时,I2全部转化为I-,蓝色褪去,但I-易被空气中的O2氧化为I2,故又返回蓝色。 -
第20题:
下列物质的颜色为:I2(),I2溶于CCl4中(),I2溶于乙醇中(),少量I2溶于KI溶液中()
正确答案:紫黑色;紫色;红棕色;黄色 -
第21题:
25g的CCl4中溶有0.5455g某溶质,与此溶液成平衡的CCl4蒸气分压为11.1888kPa,而在同一温度时纯CCl4的饱和蒸气压为11.4008kPa。根据元素分析结果,溶质中含C为94.34%,含H为5.66%(质量百分数),确定溶质的化学式。
正确答案: 1mol溶质B中,含C元素的物质的量
NC=(178×0.9434/12.011)mol≈14mol
含H元素的物质的量
NH=(178×0.0566/1.0079)mol≈10mol
所以,溶质B的化学式为:C14H10。 -
第22题:
问答题25℃时,Br2在CCl4和水中的分配比为29.0,取一定体积含溴水溶液用等体积的CCl4萃取2次后,集中2次的CCl4溶液,用等体积的纯水洗一次(反萃取),计算Br2的得率。正确答案: Br2的得率为96.67%解析: 暂无解析 -
第23题:
单选题在含有相同浓度的Cl-、Br-、I-的溶液中,逐滴加入AgNO3溶液,沉淀顺序为()。AAgBr、AgCl、AgI
BAgI、AgBr、AgCl
CAgBr、AgI、AgCl
DAgCl、AgBr、AgI
正确答案: D解析: 暂无解析
