报送新药时不需要提供的资料是A.研制依据及制造方法B.检验数据C.药理及毒理试验结果D.开发单位财务年报E.质量标准及起草说明
题目
报送新药时不需要提供的资料是
A.研制依据及制造方法
B.检验数据
C.药理及毒理试验结果
D.开发单位财务年报
E.质量标准及起草说明
相似考题
更多“报送新药时不需要提供的资料是A.研制依据及制造方法B.检验数据C.药理及毒理试验结果D.开发单位财 ”相关问题
-
第1题:
新版《药品管理法》规定:开展药物临床试验申报,应当按照国务院药品监督管理部门的规定如实报送( )等有关数据、资料和样品,经国务院药品监督管理部门批准。A、药品研制的方法
B、药品的质量指标
C、开展药理及毒理试验结果
D、临床试验数据
正确答案:ABC
-
第2题:
申办者提供的研究者手册不包括:()
A.试验用药的化学资料和数据
B.试验用药的化学、药学资料和数据
C.试验用药的化学、毒理学资料和数据
D.试验用药的生产工艺资料和数据
答案D -
第3题:
属于化学药品注册申报资料中“综述资料”的是( )。
A.立题目的与依据
B.对主要研究结果的总结及评价
C.药学研究资料综述
D.药理毒理研究资料综述
E.证明性文件
正确答案:ABE
-
第4题:
电梯()等相关单位应当向检验机构提供有关的技术资料,并安排相关的专业人员到现场配合检验。
A.制造
B.安装
C.设计
D.受检单位及维修保养
正确答案:D
-
第5题:
[113~114]
A.1年
B.2年
C.3年
D.5年
E.6年
根据《中华人民共和国药品管理法实施条例》
113.药品申报者在申报临床试验时,报送虚假研制方法、质量标准、药理及毒理试验结果等有关资料和样品,情节严重的,几年内不受理该药品申报者申报该品种的临床试验申请
正确答案:C
-
第6题:
,报送新药时不需要提供的资料是
A、研制依据
B、检验数据
C、药理试验结果
D、开发单位财务年报
E、质量标准
参考答案:D
-
第7题:
申报新药时必须报送的药理、毒理研究资料有:①主要药效学试验资料;②一般药理试验资料;③急性毒性,长期毒性试验资料;④致突变,致癌试验资料等。A.①+②+③+④
B.①+②+③
C.①+③
D.③+④
E.以上均不正确申报Ⅰ类新药须报送的资料有答案:A解析: -
第8题:
新药进行临床试验必须提供A.系统药理研究数据
B.急慢性毒性观察结果
C.新药作用谱
D.LD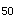
E.临床前研究资料答案:E解析: -
第9题:
新药生产申请初审和现场核查时,省、自治区、直辖市药品监督管理部门应当自受理申请之日起5日内组织的核查内容是()
- A、药物研制情况
- B、原始资料
- C、临床试验情况及原始资料
- D、药物研制情况及原始资料
- E、检验用样品
正确答案:C -
第10题:
新药进行临床试验必须提供?()
- A、系统药理研究数据
- B、慢性毒性实验结果
- C、LD50
- D、临床前研究资料
- E、核算药物成本
正确答案:A,B,C,D -
第11题:
新药进行临床试验必须提供:
- A、急性毒性观察结果
- B、药物的成本
- C、慢性毒性观察结果
- D、系统药理研究数据
- E、临床前研究资料
正确答案:A,C,D,E -
第12题:
多选题新药进行临床试验必须提供:A急性毒性观察结果
B药物的成本
C慢性毒性观察结果
D系统药理研究数据
E临床前研究资料
正确答案: C,B解析: 暂无解析 -
第13题:
下列哪一项不是申办者在临床试验前必须准备和提供的?()
A.试验用药品
B.药品生产条件的资料
C.该药的质量检验结果
D.该药的处方组成及制造工艺
答案B -
第14题:
申报五类中药新药制剂,不需报送的资料是
A.主要药效学试验
B.一般药理试验
C.急性毒性试验
D.长期毒性试验
E.致突变试验
正确答案:E
-
第15题:
新药进行临床试验必须提供()
A.系统药理研究数据
B.新药作用谱
C.临床前研究资料
D.LD50
E.急慢性毒理研究数据
正确答案:C
-
第16题:
申报二类中药新药制剂,不需报送的资料是
A.主要药效学试验
B.一般药理试验
C.急性毒性试验
D.长期毒性试验
E.致突变试验
正确答案:E
E。申报二类中药新药制剂,不需要报送致突变试验资料、致癌试验资料及生殖毒性试验资料。故本题最佳答案为E。
-
第17题:
中药新药评价,可免作
A.一般药理
B.毒理试验
C.Ⅰ期临床
D.Ⅱ期临床
E.Ⅲ期临床
正确答案:C
-
第18题:
新药进行临床试验必须提供A.系统药理研究数据
B.急慢性毒性观察结果
C.新药作用谱
D.LD.50
E.临床前研究资料答案:E解析:新药进行临床试验必须提供临床前研究资料。 -
第19题:
报送新药时不需要提供的资料是A.研制依据B.检验数据C.药理试验结果D.开发单位财务年报E.质量标准答案:D解析:按照新药报送时需要提供资料的要求,即可选出答案。 -
第20题:
()是决定候选药物能否成为新药上市销售的关键阶段。A.Ⅳ期临床试验
B.Ⅰ期临床试验
C.药理毒理研究
D.药品再注册答案:C解析:药物临床试验是指要以药品上市注册为目的,为确定药物安全性与有效性在人体开展的药物研究。药物临床试验是决定候选药物能否成为新药上市销售的关键阶段。故选C。 -
第21题:
新药临床试验申请初审和现场核查时,省、自治区、直辖市药品监督管理部门应当自受理申请之日起5日内组织的核查内容是()
- A、药物研制情况
- B、原始资料
- C、临床试验情况及原始资料
- D、药物研制情况及原始资料
- E、检验用样品
正确答案:D -
第22题:
新药进行临床试验必须提供()
- A、系统药理研究数据
- B、急、慢性毒性观察结果
- C、新药作用谱
- D、LD50
- E、临床前研究资料
正确答案:E -
第23题:
单选题新药进行临床试验必须提供()A系统药理研究数据
B急、慢性毒性观察结果
C新药作用谱
DLD50
E临床前研究资料
正确答案: A解析: 暂无解析
