CK的亚基有A.1个B.2个C.3个D.4个E.5个
题目
CK的亚基有
A.1个
B.2个
C.3个
D.4个
E.5个
相似考题
更多“CK的亚基有 A.1个 B.2个 C.3个 D.4个 E.5个 ”相关问题
-
第1题:
A.1个
B.2个
C.3个
D.4个
E.5个PKA中的每个调节亚基可结合cAMP的分子数为答案:B解析:
蛋白激酶(PKA)活化后,可使蛋白底物的丝氨酸或苏氨酸残基发生磷酸化,改变其活性状态。cAMP对细胞的调节作用是通过激活PKA来实现的。PKA属于丝(苏)氨酸蛋白激酶类,是由两个催化亚基(C)和两个调节亚基(R)组成的四聚体的别构酶(C R
R ),每个调节亚基上有2个cAMP的结合位点。催化亚基具有催化底物蛋白质某些特定丝/苏氨酸残基磷酸化的功能。调节亚基与催化亚基结合时,PKA呈无活性状态。当4分子cAMP与2个调节亚基结合后,调节亚基脱落,游离的催化亚基具有蛋白激酶活性。因此每个调节亚基可结合2分子的cAMP。
),每个调节亚基上有2个cAMP的结合位点。催化亚基具有催化底物蛋白质某些特定丝/苏氨酸残基磷酸化的功能。调节亚基与催化亚基结合时,PKA呈无活性状态。当4分子cAMP与2个调节亚基结合后,调节亚基脱落,游离的催化亚基具有蛋白激酶活性。因此每个调节亚基可结合2分子的cAMP。 -
第2题:
 A.1个
A.1个
B.2个
C.3个
D.4个
E.5个答案:C解析: -
第3题:
PKA所含亚基数为
A.1个
B.2个
C.3个
D.4个
4 -
第4题:
A.1个
B.2个
C.3个
D.4个
E.5个PKA所含的亚基数为答案:D解析:
蛋白激酶(PKA)活化后,可使蛋白底物的丝氨酸或苏氨酸残基发生磷酸化,改变其活性状态。cAMP对细胞的调节作用是通过激活PKA来实现的。PKA属于丝(苏)氨酸蛋白激酶类,是由两个催化亚基(C)和两个调节亚基(R)组成的四聚体的别构酶(C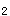 R
R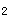 ),每个调节亚基上有2个cAMP的结合位点。催化亚基具有催化底物蛋白质某些特定丝/苏氨酸残基磷酸化的功能。调节亚基与催化亚基结合时,PKA呈无活性状态。当4分子cAMP与2个调节亚基结合后,调节亚基脱落,游离的催化亚基具有蛋白激酶活性。因此每个调节亚基可结合2分子的cAMP。
),每个调节亚基上有2个cAMP的结合位点。催化亚基具有催化底物蛋白质某些特定丝/苏氨酸残基磷酸化的功能。调节亚基与催化亚基结合时,PKA呈无活性状态。当4分子cAMP与2个调节亚基结合后,调节亚基脱落,游离的催化亚基具有蛋白激酶活性。因此每个调节亚基可结合2分子的cAMP。 -
第5题:
乙脑病毒有几个血清型A.1个
B.2个
C.3个
D.4个
E.5个答案:A解析:乙脑病毒只有一个血清型,抗原性稳定,很少变异。
