临床试验方案中应包括试验用药的登记与记录制度。安慰剂可不必记录。()
题目
临床试验方案中应包括试验用药的登记与记录制度。安慰剂可不必记录。()
相似考题
更多“临床试验方案中应包括试验用药的登记与记录制度。安慰剂可不必记录。()”相关问题
-
第1题:
临床试验中所有观察结果和发现都加以核实,以保证数据可靠性的是A、试验方案
B、记录与报告
C、试验用药品
D、质量保证
E、多中心试验
参考答案:D
-
第2题:
中国药物临床试验质量管理规范要点是A、药物临床试验前的准备与必要条件和受试者的权益保障
B、药物临床试验方案,研究者的职责,申办者和监察员的职责
C、记录与报告,数据管理与统计分析
D、试验用药品的管理质量保证
E、多中心临床试验
参考答案:ABCDE
-
第3题:
《药品临床试验管理规范》是临床试验全过程的标准规定,包括
A、试验条件、组织、实施、监督、稽查、记录、分析总结和报告
B、方案设计、机构人员、实施、监查、稽查、记录、分析总结和报告
C、方案设计、组织、实施、监查、稽查、记录、分析总结和报告
D、方案设计、组织、规程、监查、稽查、记录、分析总结和报告
E、方案设计、组织、实施、检查方法、记录、分析总结和报告
参考答案:C
-
第4题:
我国目前GCP实施过程中,尚存在以下问题A、对实施GCP的重要性认识不足;有些药物临床试验设计方案过于简单、缺乏保证实验数据准确收集的严谨措施
B、伦理委员会在药物临床试验中的作用,尚未得到充分发挥;在获得知情同意书的情况下,开始药物临床试验;药物临床试验方案的变更存在随意性
C、病例报告表设计不合理,记录不准确,甚至记录缺失;缺乏对受试者依从性的监控方法,以致试验过程中脱落病例过多;标准操作规程制定滞后
D、药物临床试验质量保证系统不健全;临床试验未按规定保留临床试验的原始记录,或保留时间不足
E、试验用药品管理不规范
参考答案:ABCDE
-
第5题:
关于临床试验,叙述错误的是()
- A、监查员是由申办者任命并对申办者负责的具备相关知识的人员,其任务是监查和报告试验的进行情况和核实数据
- B、稽查是药品监督管理部门对一项临床试验的有关文件、设施、记录和其他方面进行官方审阅
- C、病例报告表是用以记录每一名受试者在试验过程中数据的原始文件
- D、试验用药品包括用于临床试验中的试验药物、对照药品或安慰剂
- E、合同研究组织(CRO)是一种学术性或商业性的科学机构,申办者可委托其执行临床试验中的某些工作和任务
正确答案:B,C -
第6题:
《药品临床试验管理规范》是有关临床试验全过程的标准规定,包括方案设计、组织、实施、监查、稽查、记录、分析、总结和报告的方法。()
正确答案:正确 -
第7题:
临床试验中随机分配受试者只需严格按试验方案的设计步骤执行,不必另外记录。
正确答案:错误 -
第8题:
判断题临床试验中随机分配受试者只需严格按试验方案的设计步骤执行,不必另外记录。A对
B错
正确答案: 错解析: 暂无解析 -
第9题:
单选题临床试验中所有观察结果和发现都加以核实,以保证数据可靠性的是()A试验方案
B记录与报告
C试验用药品
D质量保证
E多中心试验
正确答案: C解析: 暂无解析 -
第10题:
判断题临床试验方案中应包括试验用药的登记与记录制度。安慰剂可不必记录。A对
B错
正确答案: 对解析: 暂无解析 -
第11题:
多选题关于临床试验,叙述错误的是()A监查员是由申办者任命并对申办者负责的具备相关知识的人员,其任务是监查和报告试验的进行情况和核实数据
B稽查是药品监督管理部门对一项临床试验的有关文件、设施、记录和其他方面进行官方审阅
C病例报告表是用以记录每一名受试者在试验过程中数据的原始文件
D试验用药品包括用于临床试验中的试验药物、对照药品或安慰剂
E合同研究组织(CRO)是一种学术性或商业性的科学机构,申办者可委托其执行临床试验中的某些工作和任务
正确答案: E,B解析: 暂无解析 -
第12题:
判断题临床试验方案中应包括不良事件的评定记录和报告方法,处理并发症的措施以及事后随访的方式和时间。()A对
B错
正确答案: 对解析: 暂无解析 -
第13题:
药品临床试验管理规范是临床试验全过程的标准规定,其包括A、分析总结和报告
B、监察、稽查、记录
C、组织、实施
D、方案设计
E、方案设计、组织、实施、监察、稽查、记录、分析总结和报告
参考答案:E
-
第14题:
"药品临床试验管理规范"规定,临床试验过程必须包括
A.方案设计、组织、实施、监查、稽查、记录、分析总结和报告
B.分析总结和报告
C.方案设计,组织实施
D.组织、实施、监督稽查
E.监查、稽查、记录、分析归纳
正确答案:A
-
第15题:
药品临床试验管理规范是临床试验全过程的标准规定,其包括
A.分析总结和报告
B.监查、稽查、记录
C.组织、实施
D.方案设计
E.方案设计、组织、实施、监查、稽查、记录、分析总结和报告
正确答案:E
-
第16题:
临床试验中采用安慰剂对照可 ( )
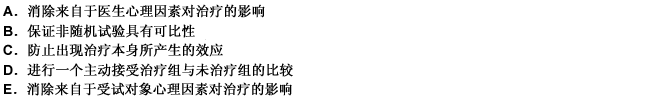 正确答案:E
正确答案:E
-
第17题:
在临床试验方案中有关试验药品管理的规定不包括:()
- A、药品保存
- B、药品分发
- C、药品的登记与记录
- D、如何移交给非试验人员
正确答案:D -
第18题:
临床试验方案中应包括试验用药、安慰剂和对照药的登记和记录制度()
正确答案:正确 -
第19题:
试验用药品的登记、保管和分发只要按临床试验方案执行,就不需要另外建立管理制度和记录系统。()
正确答案:错误 -
第20题:
判断题试验用药品的登记、保管和分发只要按临床试验方案执行,就不需要另外建立管理制度和记录系统。()A对
B错
正确答案: 错解析: 暂无解析 -
第21题:
单选题在临床试验方案中有关试验药品管理的规定不包括:()A药品保存
B药品分发
C药品的登记与记录
D如何移交给非试验人员
正确答案: A解析: 暂无解析 -
第22题:
判断题临床试验方案中应包括试验用药、安慰剂和对照药的登记和记录制度()A对
B错
正确答案: 对解析: 暂无解析 -
第23题:
单选题《药品临床试验管理规范》是临床试验全过程的标准规定,包括()A试验条件、组织、实施、监督、稽查、记录、分析总结和报告
B方案设计、机构人员、实施、监查、稽查、记录、分析总结和报告
C方案设计、组织、实施、监查、稽查、记录、分析总结和报告
D方案设计、组织、规程、监查、稽查、记录、分析总结和报告
E方案设计、组织、实施、检查方法、记录、分析总结和报告
正确答案: B解析: 暂无解析
