已知25℃时BaCrO4与BaSO4的KSP分别为1.17×10-10和1.07×10-10,此时关于下述反应方向的说法正确的是( )。A 一定正向自发进行 B 一定逆向自发进行 C 若 浓度足够,反应正向自发 D 若 浓度足够,反应正向自发
题目
B 一定逆向自发进行
C 若
 浓度足够,反应正向自发
浓度足够,反应正向自发
D 若
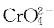 浓度足够,反应正向自发
浓度足够,反应正向自发相似考题
更多“已知25℃时BaCrO4与BaSO4的KSP分别为1.17×10-10和1.07×10-10,此时关于下述反应方向的说法正确的是( )。”相关问题
-
第1题:
已知25℃时BaCrO4与BaSO4的KSP分别为1.17×10-10和1.07×10-10,此时关于下述反应方向的说法正确的是( )。A、一定正向自发进行
B、一定逆向自发进行
C、若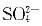 、、、浓度足够,反应正向自发
、、、浓度足够,反应正向自发
D、若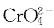 、、、浓度足够,反应正向自发答案:C解析:
、、、浓度足够,反应正向自发答案:C解析: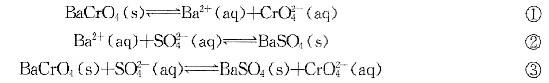 其中反应②的KSP为1/1.07×10-10,反应③的KSP为1.17×10-10×1/1.07×10-10
其中反应②的KSP为1/1.07×10-10,反应③的KSP为1.17×10-10×1/1.07×10-10
反应③的△G=△rGm=RTlnKSP=-RTln1.09<0,所以反应可以自发进行,但是,能否自发进行还与实际条件有关 -
第2题:
25℃时AgCl在纯水中的溶解度为1.34×10-5mol/L,则该温度下AgCl的Ksp值为()。
- A、8.8×10-10
- B、5.6×10-10
- C、3.5×10-10
- D、1.8×10-10
正确答案:D -
第3题:
Ag2CrO4的Ksp=2.0×10-12,AgCl的Ksp=1.6×10-10,则Ag2CrO4比AgCl更难溶解于水。
正确答案:错误 -
第4题:
AgCl的Ksp=1.8×10-10 ,当0.1M的AgNO3溶液和0.1NaCl等体积混合时,没有AgCl沉淀生成。
正确答案:错误 -
第5题:
AgNO3与NaCl反应,在等量点时Ag+的浓度为()已知KSP(AgCl)=1.80×10-10()。
- A、2.00×10-5
- B、1.34×10-5
- C、2.00×10-6
- D、1.34×10-6
正确答案:B -
第6题:
已知25℃度时Ksp,BaSO4=1.8×10-10,计算在400ml的该溶液中由于沉淀的溶解而造成的损失为()g。
- A、6.5×10-4
- B、1.2×10-3
- C、3.2×10-4
- D、1.8×10-7
正确答案:B -
第7题:
在海水中c(Cl-)≈10-5mol/L,c(I-)≈2.2´10-13mol/L,此时加入AgNO3试剂问()先沉淀,已知:Ksp(AgCl)=1.8´10-10,Ksp(AgI)=8.3´10-17
- A、Cl-
- B、I-
- C、同时沉淀
- D、不发生沉淀
正确答案:A -
第8题:
已知KspӨ(Ag2SO4)=1.8×10-5,KspӨ(AgCl)=1.8×10-10,KspӨ(BaSO4)=1.8×10-10,将等体积的0.0020mol·L-1Ag2SO4与2.0×10-6mol·L-1的BaCl2的溶液混合,将会出现()
- A、BaSO4沉淀
- B、AgCl沉淀
- C、AgCl和BaSO4沉淀
- D、无沉淀
正确答案:C -
第9题:
已知298K时,Kθsp(BaSO4)=1.1×10-10,其相对分子质量为233.3。若将1.0×10-3molBaSO4溶于10L水中形成饱和溶液,则未溶解的BaSO4的质量为0.21g。
正确答案:正确 -
第10题:
已知KSP•AgCl=1.8×10-10,KSP•AgI=8.7×10-17,两者比较,更难溶解的是()。
正确答案:AgI -
第11题:
已知KspΘ(Ag2SO4)=1.20×10-5,KspΘ(AgCl)=1.77×10-10,KspΘ(BaSO4)=1.08×10-10,将等体积的0.0020mol·L-1的Ag2SO4与2.0×10-6mol·L-1的BaCl2溶液混合,将会出现()
- A、BaSO4沉淀
- B、AgCl沉淀
- C、BaSO4与AgCl共沉淀
- D、无沉淀
正确答案:C -
第12题:
Ag+、Pb2+、Ba2+混合溶液中,各离子浓度均为0.10mol/L,往溶液中滴加K2Cr2O7试剂,最先生成的沉淀是(),最后生成的沉淀是()。 设Ni2+、Cd2+两溶液离子浓度相同,若分别通入H2S至饱和,形成()沉淀时介质的酸度可以较大。(Ksp,PbCrO4=1.77×10-14,Ksp,BaCrO4=1.17×10-10,Ksp,Ag2CrO4=9.0×10-12,Ksp,NiS=3×10-21,Ksp,CdS=3.6×10-29)。
正确答案:PbCrO4;Ag2CrO4;CdS -
第13题:
已知25℃时AgCl与Ag2CO3的KSP分别为1.77×10-10和8.45×10-12,我们可以得出在室温下( )。A 只要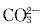 的浓度足够,AgCl(s)可直接转化可为Ag2CO3(s)
的浓度足够,AgCl(s)可直接转化可为Ag2CO3(s)
B AgCl(s)不可能直接转化可为Ag2CO3(s)
C 只要Cl-的浓度足够,Ag2CO3(s)也不可直接转化可为AgCl(s)
D 因无各物质的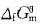 值,故这里不能判断上述反应的方向答案:B解析:
值,故这里不能判断上述反应的方向答案:B解析: ①
①
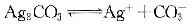 ②
②
 ③
③
对于反应③的平衡常数可由①②求得,其KSP=(1.77×10-10)2/8.45×10-12
△G=-RTlnKSP>0,所以,反应③不会自发进行 -
第14题:
AgCl的Ksp=1.76×10-10,Ag3PO4的Ksp=1.05×10-10,在Cl-和PO43-浓度相同的溶液中,滴加AgNO3溶液,先析出 Ag3PO4沉淀
正确答案:错误 -
第15题:
已知KspΘ(Ag2SO4)=1.2×10-5,KspΘ(AgCl)=1.8×10-10,KspΘ(BaSO4)=1.1×10-10。将等体积的0.0020mol·L-1的Ag2SO4与2.0×10-6mol·L-1的BaCl2溶液混合,将()
- A、只生成BaSO4沉淀
- B、只生成AgCl沉淀
- C、同时生成BaSO4和AgCl沉淀
- D、有Ag2SO4沉淀生成
正确答案:C -
第16题:
25℃时,AgCl的KSP=1.8³10-10,则AgCl的溶解度是()mol/L。
- A、1.8×10-5
- B、1.76×10-7
- C、1.34×10-5
- D、1.5×10-8
正确答案:C -
第17题:
AgCl的Ksp=1.8×10-10则,AgCl溶解度的计算公式为S=Ksp1/2=(1.8×10-10)1/2。
正确答案:正确 -
第18题:
已知25℃,φ(Ag+/Ag)=0.799V,AgCl的Ksp=1.8×10-10,当[Cl-]=1.0mol/L,该电极电位值()V。
- A、0.799
- B、0.2
- C、0.675
- D、0.858
正确答案:B -
第19题:
氯化银的Ksp=1.8×10-10,Ag2CrO4的Ksp=2.0×10-12,而两个银盐的溶解度S(单位:mol/l)的关系是SAgCl()SAg2CrO4。
正确答案:小于 -
第20题:
原子和夸克的直径大小分别为()米。
- A、10-14、10-15
- B、10-10、10-19
- C、10-10、10-15
- D、10-14、10-10
正确答案:B -
第21题:
将1mmolBaSO4(分子量为233)溶于10L水中,在该温度下Ksp(BaSO4)=1.0×10-10,问此时有多少克样品未溶解?()
- A、0.0021
- B、0.021
- C、0.21
- D、0.233
正确答案:C -
第22题:
微溶化合物BaSO4在200mL纯水中损失为()mg;若加入过量BaCl2保持[Ba2+]=0.01mol/L,其损失量为()mg。 [Mr(BaSO4)=233 Ksp(BaSO4)=1.1×10-10]
正确答案:0.5mg;5×10-4mg -
第23题:
在Ca2+和Ba2+混合液中,c(Ca2+)= 1.0*10-3mol·L-1,c( Ba2+)=1.0*10-2mol·L-1。向其中滴加Na2SO4溶液,通过计算说明可否将两者分离?( 忽略体积变化) 已知:Kspθ(BaSO4)= 1.1*10-10,Kspθ(CaSO4)= 7.1*10-5
正确答案: 根据Kspθ(BaSO4)=1.1*10-10,Kspθ(CaSO4)=7.1*10-5可知,
BaSO4比较容易生成沉淀,当Ba2+沉淀完全时,即c(Ba2+)〈1.0*10-6mol/L时,
C1(SO42-)=[Kspθ(BaSO4)]/C(Ba2+)=(1.1*10-10)/(1.0*10-6)=1.1*10-2
Ca2+开始沉淀时,
C2(SO42-)=[Kspθ(CaSO4)]/ C(Ca2+)=(7.1*10-5)/(1.0*10-3)=7.1*10-2
由此可知,当Ba2+完全沉淀时,Ca2+还没有完全沉淀,故此可将两者分离。 -
第24题:
因为Ag2CrO4的溶度积(KSPθ=2.0×10-12)小于AgCl的溶度积(KSPθ=1.6×10-10),所以,Ag2CrO4必定比AgCl更难溶于水。
正确答案:错误
