在下列CaO、MgO、NaF晶格能大小的顺序中,正确的是哪一组? A. MgO>CaO>NaF C. CaO>MgO>NaF B. NaF>CaO>MgO D. NaF>MgO>CaO
题目
B. NaF>CaO>MgO D. NaF>MgO>CaO
相似考题
更多“在下列CaO、MgO、NaF晶格能大小的顺序中,正确的是哪一组? ”相关问题
-
第1题:
下列物质的熔点由高到低排列顺序正确的是:
A. HI>HBr>HCl>HF B. HF>HI>HBr>HCl
C. SiC>SiCl4 >CaO>MgO D. SiC>CaO>MgO>SiCl4答案:B解析:解:SiC为原子晶体,溶点最高;CaO和MgO为离子晶体,熔点次之;HF、HCl、HBr、HI和SiCl4 为分子晶体,熔点较低。离子晶体中,晶格能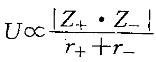 ,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。 -
第2题:
硅石中的CaO和MgO含量较高,冶炼时就会增加渣量,并侵蚀出铁口,为此要求硅石中CaO+MgO要()
正确答案:<1% -
第3题:
下列晶格能大小顺序中正确的是哪个?()
- A、CaO>KCl>MgO>NaCl
- B、NaCl>KCl>RbCl>SrO
- C、MgO>RbCl>SrO>BaO
- D、MgO>NaCl>KCl>RbCl
正确答案:D -
第4题:
在下列元素电负性大小顺序中,正确的是哪一组?()
- A、B>Al>Be≈Mg
- B、B>Be≈Al>Mg
- C、B≈Al
- D、Be>B>Al>Mg
正确答案:B -
第5题:
排出下列四种物质碱性强弱的顺序:K2O、Rb2O、MgO、CaO
正确答案:Rb2O;K2O;CaO;MgO -
第6题:
若炉渣中含氧化镁较高,则碱度的正确表达式为:()。
- A、R=SiO2%/(CaO%+MgO%)
- B、R=CaO%/(SiO2%+MgO%)
- C、R=(CaO%+MgO%)/SiO2%
正确答案:C -
第7题:
在转炉炼钢中,炉渣氧化性是指()。
- A、渣中CaO、MgO、FeO、MnO、P2O5等氧化物总和
- B、渣中CaO、MgO总和
- C、渣中FeO、Fe2O3浓度总和
- D、所有氧化物的总和
正确答案:C -
第8题:
MgO,CaO,SrO,BaO四种氧化物均为NaCl型晶体,在它们的晶体中正离子半径的大小顺序为(),由此可得出晶格能的大小顺序为(),熔点高低顺序为()。
正确答案:Ba2+>Sr2+>Ca2+>Mg2+;MgO>CaO>SrO>BaO;MgO>CaO>SrO>BaO -
第9题:
氧化物MgO、CaO、SrO、BaO均是NaCl型离子晶体,据离子键理论定性比较它们的晶格能大小和熔点的高低。
正确答案:阴离子相同,阳离子半径从左到右逐渐增大,离子间作用力逐渐减弱,所以从左到右,各离子化合物的晶格能逐渐减小,熔点逐渐降低。 -
第10题:
在离子晶体NaCl、MgO、CaO、BaO中,熔点最高的是()。
正确答案:MgO -
第11题:
单选题在下列CaO、MgO、NaF晶格能大小的顺序中,正确的是哪一组?()AMgO>CaO>NaF
BNaF>CaO>MgO
CCaO>MgO>NaF
DNaF>MgO>CaO
正确答案: A解析: 暂无解析 -
第12题:
单选题在下列元素电负性大小顺序中,正确的是哪一组?()AB>Al>Be≈Mg
BB>Be≈Al>Mg
CB≈Al
DBe>B>Al>Mg
正确答案: B解析: 暂无解析 -
第13题:
离子键的强弱主要决定于离子的半径和离子的电荷值。一般规律是离子半径越小,电荷值越大,离子键越强。K20、Mg0、Ca0三种物质中离子键由强变弱的顺序是()。
A.K2O、MgO、CaO
B.MgO、CaO、K20
C.MgO、K2O、CaO
D.CaO、MgO、K2O答案:B解析:离子半径的大小顺序是Mg2+<Ca2+<K+,因此离子键最强的是氧化镁,其次是氧化钙,最弱的是氧化钾。故本题选B。 -
第14题:
以下几种氧化物,稳定性由弱到强排列正确的一组是()
- A、SiO2;Al2O3;MgO;CaO
- B、SiO2;Al2O3;CaO;MgO
- C、SiO2;MgO;Al2O3;CaO
- D、Al2O3;SiO2;MgO;CaO
正确答案:A -
第15题:
NaF和MgO中离子的电子构型相同,但MgO的硬度是NaF的两倍,MgO的熔点为2800℃,比NaF的熔点993℃高得多,为什么?
正确答案:NaF和MgO均为离子化合物,其结合力离子键与离子半径、电荷和电子构型有关,NaF和MgO比较,后者离子电荷的乘积比前者大4倍,所以离子间的结合力大,离子键牢固,其硬度和熔点都要大得多。 -
第16题:
在下列CaO、MgO、NaF晶格能大小的顺序中,正确的是哪一组?()
- A、MgO>CaO>NaF
- B、NaF>CaO>MgO
- C、CaO>MgO>NaF
- D、NaF>MgO>CaO
正确答案:A -
第17题:
以下因素中()提高炉渣粘度。
- A、2CaO.SiO2多
- B、2CaO.SiO2少
- C、MgO多
- D、MgO少
正确答案:A,C -
第18题:
下列炉渣氧化物按碱度强弱的排列顺序是( )。
- A、CaO、MnO、FeO、MgO
- B、MgO、CaO、MnO、FeO
- C、CaO、MgO、MnO、FeO
正确答案:C -
第19题:
下列晶格能大小顺序中正确的是()
- A、CaO>KCl>MgO>NaCl
- B、NaCl>KCl>RbCl>SrO
- C、MgO>RbCl>SrO>BaO
- D、MgO>NaCl>KCl>RbCl
正确答案:D -
第20题:
下列两组物质:①MgO、CaO、SrO、BaO②KF、KCl、KBr、KI每组中熔点最高的分别是()。
- A、BaO和KI
- B、CaO和KCl
- C、SrO和KBr
- D、MgO和KF
正确答案:D -
第21题:
下列物质晶格能大小顺序中正确的是()
- A、MgO>CaO>NaF
- B、CaO>MgO>NaF
- C、NaF>MgO>CaO
- D、NaF>CaO>MgO
正确答案:A -
第22题:
单选题下列物质,熔点自高而低的顺序为( )。ACaO,MgO,PH3,NH3
BNH3,PH3,MgO,CaO
CNH3,CaO,PH3,MgO
DMgO,CaO,NH3,PH3
正确答案: C解析:
固体的熔点一定大于气体的熔点,排除BC两项。一般来说,物质的熔点原子晶体>离子晶体>金属晶体>分子晶体。原子晶体:取决于共价键的键长和键能,键长越短,键能越大,熔沸点越高;离子晶体:一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高;分子晶体:组成和结构相似的物质,其分子量越大,分子间作用力越强,熔沸点就越高。 -
第23题:
单选题在下列元素电负性大小顺序中,正确的是哪一组()?AB>Al>Be≈Mg
BB>Be≈Al>Mg
CB≈Al
DBe>B>Al>Mg
正确答案: B解析: 暂无解析 -
第24题:
单选题下列晶格能大小顺序正确的是( )。ACaO>KCl>MgO>NaCl
BNaCl>KCl>RbCl>SrO
CMgO>RbCl>SrO>BaO
DMgO>NaCl>KCl>RbCl
正确答案: D解析:
对晶体构型相同的离子化合物,离子电荷数越多,荷间距越短,晶格能就越大。
