NA为阿伏加德罗常数的值。下列说法正确的是( )
题目
NA为阿伏加德罗常数的值。下列说法正确的是( )


相似考题
更多“NA为阿伏加德罗常数的值。下列说法正确的是( ) ”相关问题
-
第1题:
下列有关阿伏加德罗常数NA的表达正确的是( )。
A.它是由意大利科学家阿伏加德罗测出来的
B.它的数值等于6.02×1023
C.它是一个有量纲的常数
D.它的单位是摩尔答案:C解析:单位物质的量的物质含有的粒子数叫阿伏加德罗常数,符号是NA,单位为mol-1,它与0.012kg12C中所含碳原子数相等,大约为6.02×1023,也就是NA约为6.02x1023mol-1。由此判断,B、D两项错误,C项正确。阿伏加德罗常数因阿莫迪欧·阿伏加德罗得名,阿伏加德罗常数的值最早是由约翰·约瑟夫·洛施米特于1865年测出,A项错误。 -
第2题:
某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。
设NA表示阿伏加德罗常数的值,下列说法正确的是( )。
上面是某学校化学测试中的一道题,不少学生会错选为D。
回答下列问题:?
(1)本题正确答案为__________,解题思路为__________。
(2)分析学生解题错误可能是由哪些原因造成的。答案:解析:(1)AC。解题思路:在标准状况下,1mol任何气体所占体积都约为22.4L,因为决定它们体积大小的因素是气体分子问的距离.而不是分子本身体积的大小。对于混合气体,此结论也一定成立。(混合气体在标准状况下能自发反应。而导致反应前后气体分子数不等的除外,如N0和02。)所以在标准状况下1mol混合气体所占体积也是22.4L。反过来在标准状况下每22.4L气体所含分子数就一定是ⅣA。A项正确。
在标准状况下H2O并不是气态。而对于液体或固体物质来说,决定它们体积的因素是粒子本身的大小。不同粒子,其本身大小不同,体积也就不同。在标准状况下,1molH2O的体积不是22.4L。B项不正确。
物质的量和质量都是与温度、压强无关的基本物理量。也就是说.1mol物质在任何温度下,所含粒子数都仍为ⅣA(条件是该物质在此温度下能存在且不发生反应)。因此当+1价的氢被活泼金属还原成O价的氢时,只要有1molH2生成,就必然转移2mol电子,即转移电子总数为2Ⅳ (不管是标况还是常压)。C正确。
氮原子核外有7个电子,氮气分子核外有14个电子,则lmolN:含有的核外电子数就是14NA。D项不正确。
(2)错误分析:本题易错选D项,主要原因是部分同学考虑氮原子的核外电子排布时,只注意到最外层电子数为5而忽了内层电子数为2.从而得出错误结论。 -
第3题:
设ⅣA为阿伏加德罗常数的值,下列说法正确的是( )。 答案:D解析:
答案:D解析:

-
第4题:
设NA为阿伏加德罗常数的值,下列说法正确的是()。
A.标准状况下,NA个SO3分子的体积约为22.4 L
B.常温常压下,2 mol氦气所具有的原子数目为2NA
C.1L 0.2 mol·L-1的Na2S溶液中,S2-的数目为0.2NA
D.1mol Cl2与足量的Fe完全反应转移的电子数目为3NA答案:B解析:标准状况下,SO3是固体,不能用标准状况下的气体摩尔体积进行计算,A项错误;因为氦气为单原子分子,所以2 mol氦气含有的原子数为2NA,B项正确;S2-在溶液中发生水解,所以l L 0.2 mol/L的Na2S溶液中S2-的数目小于0.2NA,C项错误;氯气单质是强氧化剂,能将变价金属氧化到高价态,铁与氯气反 应.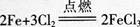 铁从0价变为+3价,l mol铁失去3 mol电子,转移电子数为N=n×NA=3XNA=3NA,但需1.5 m01氯气,所以1mol Cl2与足量的铁反应,电子转移依据氯气计算,转移电子数为2 mol,电子数为N=n×M=2×NA=2NA,D项错误。
铁从0价变为+3价,l mol铁失去3 mol电子,转移电子数为N=n×NA=3XNA=3NA,但需1.5 m01氯气,所以1mol Cl2与足量的铁反应,电子转移依据氯气计算,转移电子数为2 mol,电子数为N=n×M=2×NA=2NA,D项错误。 -
第5题:
设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.在密闭容器中.0.1 mol N2与0.3 mol H3在催化剂作用下充分反应,生成氨分子数为0.2NA个
B.标准状况下,11.2 L甲醛气体中电子数为8NA个
C.常温常压下,7.8 9苯中含有单键的数目为0.9NA
D.1 L浓度为1 mol.L-1,的Na2C03溶液中含有CO32-的数目为NA个答案:B解析:A项,氮气和氢气生成氨气是可逆反应,不能实现完全转化,不会生成0.2 mol的氨分子.A项错误;B项,标准状况下,11.2 L的甲醛气体为0.5 mol,电子数为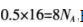 B项正确:C项.在苯中不存在C—C单键,C项错误;D项,碳酸根离子会发生水解,故碳酸钠溶液中含有的碳酸根的数目小于NA,D项错误。
B项正确:C项.在苯中不存在C—C单键,C项错误;D项,碳酸根离子会发生水解,故碳酸钠溶液中含有的碳酸根的数目小于NA,D项错误。 -
第6题:
设NA为阿伏加德罗常数的数值,下列叙述正确的是( )。 答案:A解析:A项,利用原子守恒,可推知氮原子数为0.2NA,A正确;B项,一个羟基中电子数为9,
答案:A解析:A项,利用原子守恒,可推知氮原子数为0.2NA,A正确;B项,一个羟基中电子数为9,
-
第7题:
NA为阿伏加德罗常数,下列对0.3mol/L的22SO4溶液的说法中,正确的是()
- A、1L溶液中含0.3NA个钾离子
- B、1L溶液中含0.9NA个离子(K+、SO42-)
- C、2L溶液中钾离子浓度是1.2mol/L
- D、2L溶液中含0.6NA个离子(K+、SO42-)
正确答案:B -
第8题:
NA表示阿伏加德罗常数的值,下列说法正确的是()。
- A、常温常压下,32gO2和O3的混合气体所含原子数为2NA
- B、1molCl2参加氧化还原反应,转移的电子数目一定是2NA
- C、1L1mol/LCuCl2溶液中含有的Cu2+的个数为NA
- D、20℃、1.01×105Pa时,2.24LC2H4和CO的混合气体,含气体分子数为0.1NA
正确答案:A -
第9题:
设氯原子的质量为ag,12C原子的质量为bg,用NA表示阿伏加德罗常数的值,则下列说法正确的是()
- A、氯元素的相对原子质量为12/b
- B、mg该氯原子的物质的量为m/NAmol
- C、该氯原子的摩尔质量是aNA
- D、ng该氯原子所含的电子数是17n/a
正确答案:D -
第10题:
设N为阿伏加德罗常数的值,下列叙述正确的是()。
- A、1mol氯气参加氧化还原反应,转移的电子数一定为2NA
- B、25℃时,1LpH=12的Na2CO3溶液中含有Na的数目为0.02NA
- C、12g石墨和C60的混合物中质子总数一定为6NA
- D、常温常压下,22.4L乙烯中C-H键数为4NA
正确答案:C -
第11题:
单选题设阿伏加德罗常数符号为NA,下列说法不正确的为( ).A磷酸的摩尔质量与NA个磷酸分子的质量在数值上相等
BNA个氧分子和NA个氢分子的质量比等于16∶1
C28克氮气所含的原子数目为NA
D在标准状况下,0.5NA个氮气分子所占体积是11.2升
正确答案: C解析:
C项,28g氮气的物质的量为1mol,故氮气分子的数目为NA,一个氮气分子中含有两个氮原子,所以氮原子的数目为2NA. -
第12题:
多选题下列说法正确的是(NA为阿伏加德罗常数)()A124gP4含有p—P键的个数为4NA
B12g石墨中含有C—C键的个数为1.5NA
C12g金刚石中含有C—C键的个数为2NA
D60gSi02中含Si—O键的个数为2NA
正确答案: A,D解析: 暂无解析 -
第13题:
NA表示阿伏加德罗常数,下列叙述正确的是( )。A.molFel2与足量氯气反应时转移的电子数为2NA
B.2L0.5mol/L硫酸钾溶液中阴离子所带电荷数为NA。
C.1 molNa202固体中含离子总数为4NA。
D.丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA答案:D解析:
(1 mol Fe2+和2 mol l一)与足量氯气反应时转移的电子数为3NA,A项错误;B项,2 L 0.5 mol/L硫酸钾溶液中含溶质(K2S0。)的物质的量是l mol,所以阴离子S042-的物质的量是l mol,所带电荷数为2NA,B项错误;C项,Na202是由Na+和O22-一构成,所以l mol Na2O2固体中含离子总数是3 mol,含离子总数为3NA。,C项错误;D项,丙烯和环丙烷的最简式都是CH2,则42g混合气体含有3 mol CH2,则氢原子的物质的量是6 mol,个数为6NA,D项正确。故选D。 -
第14题:
ⅣA表示阿伏加德罗常数,则下列说法正确的是( )。 答案:B解析:
答案:B解析: -
第15题:
设NA为阿伏加德罗常数的值,下列说法正确的是( )。《》()A.1 mol乙酸和1 mol乙醇充分反应生成的水分子数为NA
B.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA
C.标准状况下,1.12 L甲醇中碳原子的数目为0.05NA
D.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA答案:B解析:1 mol乙酸和1 mol乙醇的酯化反应为可逆反应,生成的水的物质的量小于1mol,水分子数小于NA,A项错误。3.0g含甲醛的冰醋酸含有0.1 mol“CH2O”,则含有0.4 mol原子,含有的原子总数为0.4NA,B项正确。标准状况下。甲醇不是气体,题干中给出的条件无法计算出甲醇的物质的量,C项错误。ClO-够发生水解,1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目小于NA,D项错误。故本题选B。 -
第16题:
设NA为阿伏加德罗常数的值,下列有关叙述正确的是()。
A.标准状况下,2.24L H2O含有的氧原子数为0.1NA。
B.常温下,14g N2中的氮原子数为0.5NA。
C.2 L 0.5 mol/L亚硫酸溶液中含有的氢离子数为2NA。
D.23gNa在空气中充分燃烧时,转移电子数为NA。答案:D解析:标准状况下H2O为液态,所以标准状况下,2.24 L H2O含有的氧原子数不是0.1NA。常温下,14 g N2中的氮原子数为NA。由于亚硫酸是弱酸,所以2 L 0.5mol/L亚硫酸溶液中含有的氢离子数小于2NA。 -
第17题:
下列化学史实陈述正确的是( )。A、拉瓦锡是最早使用天平的化学家
B、分子概念是由道尔顿最先提出的
C、阿伏加德罗常数是由阿伏加德罗测定出来的
D、苯分子的环状结构是由凯库勒提出的答案:D解析:拉瓦锡建立氧化学说揭开了燃烧现象的本质,他最早运用天平作为研究化学的工具,而埃及人最早使用天平.A项错误。分子概念是由意大利化学家阿伏加德罗最早提出的,B项错误。阿伏加德罗常数是由瑞典化学家J.J.贝采利乌斯测定的,C项错误。苯分子的环状结构是由凯库勒提出的,D项正确。故本题选D。 -
第18题:
阿伏加德罗常数为()。
- A、5.02×1023个碳原子数
- B、6.02×1023个碳原子数
- C、6.02×1023个氮原子数
正确答案:B -
第19题:
设NA为阿伏加德罗常数的值。下列叙述正确的是()。
- A、1mol甲醇中含有C-H键的数目为4NA
- B、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
- C、标准状况下,2.24L己烷含有分子的数目为0.1NA
- D、常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
正确答案:D -
第20题:
NA为阿伏加德罗常数,下列关于0.2mol/LK2SO4溶液的正确说法是()
- A、500mL溶液中所含K+、SO42-总数为0.3NA
- B、500mL溶液中含有0.1NA个K+离子
- C、1L溶液中K+离子浓度是0.2mol/L
- D、2L溶液中SO42-离子浓度是0.4mol/L
正确答案:A -
第21题:
密立根(Millikan)油滴实验测定了:()
- A、荷质比
- B、K层的电子数
- C、电子的电荷值
- D、普朗克常数
- E、阿伏加德罗常数
正确答案:C -
第22题:
单选题以NA表示阿佛加德罗常数,下列说法中正确的是()A53g碳酸钠中含NA个CO32-
B0.1molOH-含NA个电子
C1.8g重水(D2O)中含NA个中子
D标准状况下11.2L臭氧中含NA个氧原子
正确答案: D解析: 暂无解析 -
第23题:
单选题设NA为阿伏加德罗常数的值。下列叙述正确的是()。A1mol甲醇中含有C-H键的数目为4NA
B25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C标准状况下,2.24L己烷含有分子的数目为0.1NA
D常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
正确答案: C解析: 1mol甲醇中含有3molC-H键,A项错误;NaOH溶液体积未知无法计算,B项错误;己烷在标准状况下为液体,不适用气体摩尔体积,C项错误;Na2O2与足量H2O反应时,生成0.2molO2,转移0.4mol电子,D项正确。
