下面是部分元素原子或离子的结构示意图。请你仔细观察、分析,然后回答问题: ⑴上述粒子中,属于同一种元素的是( )(填序号,下同),属于阳离子的是( )。 ⑵电子层数相同,最外层电子数也相同的粒子有( )。 ⑶能与①形成AB4型分子的是( )。
题目
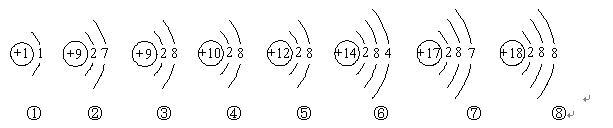
⑴上述粒子中,属于同一种元素的是( )(填序号,下同),属于阳离子的是( )。
⑵电子层数相同,最外层电子数也相同的粒子有( )。
⑶能与①形成AB4型分子的是( )。
相似考题
更多“下面是部分元素原子或离子的结构示意图。请你仔细观察、分析,然后回答问题: ”相关问题
-
第1题:
一、考题回顾
题目:《共价键》

学与问
二、考题解析
【教学过程】
环节一:生活导入
【教师引导,提出问题】上节课从微观的角度认识了物质的形成,学习了像氯化钠这种离子化合物的形成过程,请回答什么是离子键?
【学生回答】原子通过得失电子形成阴阳离子,阴阳离子间通过静电作用形成的化合物就叫做离子化合物,而这种相互作用就是离子键。
【提出问题】像H2、Cl2、HCl这些物质在形成时,两个氢原子得失电子的能力一样,此时不能形成阴阳离子,那它们是如何形成的?
环节二:新课教学
【提出问题】分析H和Cl的原子结构,思考Cl2、HCl分子的形成会与NaCl一样吗?非金属元素之间化合时,能形成离子键吗?为什么?
【学生回答】不能,因为非金属元素的原子之间得失电子的能力相差不大,都不能从对方那得到电子,无法形成阴阳离子,所以没有离子键。
1.Cl2、HCl的形成过程
【提出问题】两个氯原子结合生成Cl2分子,两个氯原子对电子的吸引能力相同,若都要达到八电子稳定结构,氯气分子是如何形成的?如何来表示?
【学生回答,教师总结】氯原子最外层有7个电子,要达到稳定的8电子结构,都需要获得1个电子,所以氯原子间难以发生电子得失;两个氯原子各提供1个电子,形成共用电子对,两个氯原子就形成了8电子稳定结构,可以表示如下:
2.共价键和共价化合物
根据教材内容,先指导学生阅读内容之后进行归纳总结。
【提出问题】原子间通过共用电子对的这种相互作用叫做什么?以共用电子对形成分子的化合物叫做什么?
【学生回答】共价键,共价化合物。
【提出问题】根据以上分析可知共价键的构成粒子和成键本质是什么?
【学生回答】原子,共用电子对。
【提出问题】根据以上分析可知共价键的组成元素是什么?
【学生回答】非金属元素。
【提出问题】任何由非金属元素组成的单质都含有共价键吗?
【学生回答】不是,比如He、Ne等稀有气体为单原子分子。
3.极性键与非极性键
【提出问题】氯气的形成过程与氯化氢的形成过程一样吗?它们的区别是什么?
【学生回答】形成过程相同,而区别在于氯气中是由同种原子形成的共价键,氯化氢中是由不同种原子形成的共价键。
【提出问题】氯气中既然形成共价键的两个原子是相同的,那么形成的共用电子对是否会发生偏移呢?用同样的方法再来思考下氯化氢又是怎样的呢?
【学生回答】像氯气是由同种原子形成的共价键,共用电子对不会发生偏移,此时形成的共价键叫做非极性共价键。而像氯化氢是由不同种原子形成的共价键,共用电子对会偏向吸引电子能力强的一方,此时形成的共价键叫做极性共价键。)
环节三:巩固提高
【提出问题】含有共价键的物质一定是共价化合物吗?
【学生讨论】①不是,比如氯化铵,铵根中含有共价键,但铵根与氯离子是通过离子键结合的,因此根据离子化合物的概念,只要含有离子键的化合物就应该属于离子化合物。
②再比如氢气,虽然含有共价键,但属于单质。
环节四:小结作业
小结:学生总结归纳本节课所学主要知识,表述学习心得。
作业:课下尝试用电子式表示氢气、氧气、氮气、氯化铵四种物质。答案:解析: -
第2题:
有A,B和C三种主族元素,若A元素阴离子与B.C元素的阳离子具有相同的电子层结构,且B的阳离子半径大于C,则这三种元素的原子序数大小次序是()
- A、B<C<A
- B、A<B<C
- C、C<B<A
- D、B>C>A
正确答案:B -
第3题:
原子化是将被分析元素或其化合物转换成原子蒸汽的过程。
正确答案:正确 -
第4题:
不同的气体或元素,由于原子结构不同,其电离电位不同。请在下面括号内填上>、<或=。钾()钠()氟。
正确答案:<;< -
第5题:
晶体类型相同而化学组成不同的矿物,其相对密度主要取决于()。
- A、所含元素的相对原子质量
- B、所含元素的离子半径
- C、所含元素的原子半径
- D、所含元素的相对原子质量及其原子或离子的半径
正确答案:D -
第6题:
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有哪些?
正确答案:1s2、2s2、3s2、4s2、3d64s2、3d94s2、3d104s2 -
第7题:
元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。请回答下列问题:(1)有人说“氦的最外层电子数为2,应该把它放在第ⅡA族”,你认为这样编排元素周期表有何利弊?(2)结合化学教学实践,论述三序结合的原则在化学教材编写中“原子结构和元素周期表”理论部分的应用。
正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知和心理发展过程和知识体系;理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。 -
第8题:
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题: (1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:()、()、()、()等。 (2)若X原子的外围电子层排布为3d104s2,Y可能是()元素或()元素(写元素符号)。 (3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:()、()、()、()、()、()、()。
正确答案:CO2;SO2;SiO2;CS2;F;Cl;1s2;2s2;3s2;4s2;3d64s2;3d94s2;3d104s2 -
第9题:
多选题X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( ).AX的原子序数比Y的小
BX原子的最外层电子数比Y的多
CX的原子半径比Y的大
DX元素的最高正价比Y的小
正确答案: B,A解析:
具有氩原子相同电子层结构的阴离子是第三周期的非金属离子(S2-、Cl-)、阳离子是第四周期的ⅠA、ⅡA的金属离子(K+、Ca2+).由于阳离子的元素位于第四周期,其原子序数与原子半径都比Y元素的大,故最高正价较小. -
第10题:
问答题已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有哪些?正确答案: 1s2、2s2、3s2、4s2、3d64s2、3d94s2、3d104s2解析: 暂无解析 -
第11题:
问答题元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。请回答下列问题:(1)有人说“氦的最外层电子数为2,应该把它放在第ⅡA族”,你认为这样编排元素周期表有何利弊?(2)结合化学教学实践,论述三序结合的原则在化学教材编写中“原子结构和元素周期表”理论部分的应用。正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知和心理发展过程和知识体系;理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。解析: 暂无解析 -
第12题:
单选题在AAS分析中,原子化器的作用是()A把待测元素转变为气态激发态原子
B把待测元素转变为气态激发态离子
C把待测元素转变为气态基态原子
D把待测元素转变为气态基态离子
正确答案: B解析: 暂无解析 -
第13题:
{图
二、考题解析
【教学过程】
(一)导入新课
【提出问题】当我们小时候因挑食而导致身体偏瘦,家长或医生会让我们吃什么呢?
【学生回答】补锌的食物或者药物。
【提出问题】教师通过多媒体展示生活中常见的保健类药物的图片,并让学生仔细观察,设疑“药品说明书上所提到的钾、钙以及镁到底是什么呢?”这就是今天这节课我们要研究的内容。
(二)新课教学
【展示图片】多媒体首先展示蛋壳、贝壳以及石灰石的图片。
【提出问题】学生观察并猜测这些物质主要的成分是什么?
【学生回答】碳酸钙。
【提出问题】碳酸钙又是由什么组成的?
【学生回答】预设学生得出不同答案“钙元素”“碳元素”“氧元素”。
【多媒体展示】运用元素测定仪对碳酸钙分析的检测报告。
【教师引导】根据分析报告,碳酸钙确实是由碳、氧、钙这三种元素共同组成的。
【提出问题】什么是元素?

【学生回答】不同物质中的氢原子的质子数都是1,核外电子数都是1.
【教师引导】将质子数都是8的氧原子统称氧元素,质子数都是1的氢原子统称氢元素。那类比这种说法,什么是碳元素?
【学生回答】将质子数为6的所有碳原子统称为碳元素。
【师生总结】师生共同总结出元素的定义:元素是质子数(即核电荷数)相同的一类原子的总称。
【多媒体播放】硫在氧气中点燃以及过氧化氢分解的微观动画。
【提出问题】在化学反应中分子、原子以及元素是否发生了变化?决定元素种类的是什么?
【学生回答】分子发生了改变,而原子以及元素的种类均没有发生变化。
【教师总结】在物质发生化学变化时,原子的种类不变,元素也不会改变,决定元素种类的是原子中的质子数。
(三)拓展提高
【学生活动】 教师列举出农业中,农民伯伯在春种时为什么要给庄家施肥?蕴含了什么化学知识?
【学生回答】补充氮元素、钾元素等有助于庄家的生长。
(四)小结作业
小结:引导学生共同总结本节课的内容。
作业:总结分子、原子以及元素之间的区别完成表格,并预习下节元素的符号的相关知识。
【板书设计】

【答辩题目解析】
?
1.在化学反应中,不变的是什么?
2.本节课中你多处使用多媒体进行辅助教学,这样设计是否合理?答案:解析:1.
化学反应前后质量守恒,元素的种类不变,原子的种类、个数、质量都不变。
2.
本节课的内容多数属于微观概念的理解和规律的总结,而此阶段的学生抽象思维能力还不够完善,面对较为抽象的微观概念和规律,理解起来较为困难,所以本节课借助多媒体动画和图片能将抽象的概念和规律具体化,既能帮学生通过直观感知来加深对知识的理解和学习,又能突破本节课难点内容,综上所述,运用多媒体进行辅助教学是合理的。 -
第14题:
()与组成材料各元素的原子量、原子(离子)半径和该材料的结构有关。
- A、相对密度
- B、密度
- C、质量
- D、重量
正确答案:B -
第15题:
原子荧光光谱仪中原子化器的作用是将样品中被分析元素转化成自由离子。
正确答案:错误 -
第16题:
下面哪种光源,不但能激发产生原子光谱和离子光谱,而且许多元素的离子线强度大于原子线强度?()
- A、直流电弧
- B、交流电弧
- C、电火花
- D、高频电感耦合等离子体
正确答案:D -
第17题:
X元素的简单阳离子和Y元素的简单阴离子具有氩原子相同的电子层结构。下列叙述正确的是()
- A、X的原子序数比Y的小
- B、X原子的电子层数比Y少
- C、X的原子半径比Y的小
- D、X元素的最高正价比Y的小
正确答案:D -
第18题:
土壤结晶矿物结构中某种原子或离子,部分地被直径大小、电价相近的其它离子或原子取代,晶体构型改变的现象叫同晶替代。
正确答案:错误 -
第19题:
()是指在确定的某种晶格中,某离子或原子部分被性质相似的它种离子或原子所替代占有。
正确答案:类质同像 -
第20题:
在AAS分析中,原子化器的作用是()
- A、把待测元素转变为气态激发态原子
- B、把待测元素转变为气态激发态离子
- C、把待测元素转变为气态基态原子
- D、把待测元素转变为气态基态离子
正确答案:C -
第21题:
问答题阅读下面文字,回答相关问题。 元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。 请回答下列问题: (1)有人说"氦的最外层电子数为2,应该把它放在第ⅡA族",你认为这样编排元素周期表有何利弊? (2)结合化学教学实践,论述三序结合的原则在化学教材编写中"原子结构和元素周期表"理论部分的应用。正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。
(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知过程和心理发展过程及知识体系:理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。解析: 暂无解析 -
第22题:
单选题X和Y均为短周期元素,X元素的阳离子和Y元素的阴离子具有相同的核外电子层结构,下列叙述正确的是( ).A原子序数X<Y
B原子半径X>Y
C原子的电子层数X<Y
D原子最外层电子数X>Y
正确答案: C解析:
X元素的阳离子和Y元素的阴离子具有相同的核外电子排布,则X元素处于Y元素的下一周期,X为金属元素,Y为非金属元素.A项,X在Y的下一周期,则原子序数X>Y;B项,X在Y的下一周期,X的电子层多,则原子半径为X>Y;C项,X在Y的下一周期,X的电子层多,则电子层数为X>Y;D项,无法判断最外层电子数的多少. -
第23题:
填空题已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题: (1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:()、()、()、()等。 (2)若X原子的外围电子层排布为3d104s2,Y可能是()元素或()元素(写元素符号)。 (3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:()、()、()、()、()、()、()。正确答案: CO2,SO2,SiO2,CS2,F,Cl,1s2,2s2,3s2,4s2,3d64s2,3d94s2,3d104s2解析: 暂无解析
