某元素的氢化物的分子式为RH4,其最高氧化物中含氧的质量分数为53%.又知该元素的原子核内质子数等于中子数.则该元素位于周期表的( )A.第二周期 B.Ⅱ A族 C.ⅣA族 D.VIA族
题目
B.Ⅱ A族
C.ⅣA族
D.VIA族
相似考题
更多“某元素的氢化物的分子式为RH4,其最高氧化物中含氧的质量分数为53%.又知该元素的原子核内质子数等于中子数.则该元素位于周期表的( )A.第二周期 B.Ⅱ A族 C.ⅣA族 D.VIA族”相关问题
-
第1题:
某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。下列叙述中不正确的是( )。A.外层电子排布为3d54s1
B.该元素为第四周期、ⅥB族元素铬
C.+3价离子的外层电子排布式为3d24s1
D.该元素的最高价氧化物的水合物为强酸答案:C解析:根据题意,最高氧化数为+6的元素有VIA族和VIB族元素;而已知最外层只有一个电子,故只能是VIB族元素;在由已知中最后一个条件“原子半径是同族元素中最小的”,可确定该元素是VIB组中的Cr,Cr的电子排布式为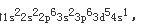
,可得出以下结论:
外层电子排布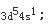
因为周期数等于电子层数,等于最高主量子数,即第四周期。他的最后一个电子填充在d亚层上,所以它是副族元素,其族数等于[(n-1)d+ns]电子层上的电子数,对Cr来讲为5+1=6,即ⅥB族元素;
因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为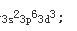
Cr的最高价氧化物CrO3,其水合物为H2CrO4或H2Cr2O7均为强酸。 -
第2题:
某元素正二价离子(M^2+)的电子构型是3s^23p^6,该元素在元素周期表中的位置是( )。A. 第三周期,第Ⅷ族
B. 第三周期,第ⅥA族
C. 第四周期,第ⅡA族
D. 第四周期,第Ⅷ族答案:C解析:该元素完整的核外电子排布为

,周期数为最高主量子数,族竖数为价电子数。由此可知,n=4,即为第四周期;价电子为2,即为第ⅡA族。 -
第3题:
原子序数是标志元素在元素周期表中次序的序号,亦即是该元素原子()
- A、核中的质子数
- B、核中的中子数
- C、核中的质子与中子数之和
- D、质量
正确答案:A -
第4题:
某元素位于周期表中36号元素之前,该元素失去2个电子以后,在角量子数l=2的轨道上正好半充满,试回答: 该元素的原子序数,符号,所处周期和族。
正确答案: 原子系数为27,元素符号为Co,第4周期,第Ⅷ族 -
第5题:
某元素的价电子构型为ns2np4,此元素在周期表中的位置是()。
- A、IIA族
- B、VIA族
- C、VIB族
- D、IVA族
正确答案:B -
第6题:
已知某元素+2价离子的核外电子排布式为:[Ar]3d5,该元素在周期表中处于()周期、()族、()区,元素符号是()。
正确答案:第四;ⅦB;d;Mn -
第7题:
超重元素的假说预言自然界中可存在原子序数为114号的稳定同位素298114X,试根据原子结构理论和元素周期律预测: (1)114X元素位于元素周期表第()周期()族,为()元素(金属、非金属)。 (2)写出该元素最高价氧化物及其对应水化物的分子式()、(),并估计后者为()(酸、两性、碱) (3)该元素与氯生成化合物的分子式()、()。
正确答案:七;IVA;金属;XO2;X(OH)4;碱;XCl2;XCl4 -
第8题:
已知某副族元素A的原子,电子最后排入3d,最高氧化数为+4;元素B的原子,电子最后排入4p,最高氧化数为+5。回答下列问题: ⑴写出A、B元素原子的核外电子排布式。 ⑵根据核外电子排布式,指出它们在周期表中的位置(周期、族)。
正确答案:⑴A:1s22s22p63s23p63d24s2;B:1s22s22p63s23p63d104s24p3。
⑵A:第四周期ⅣB族;B:第四周期ⅤA族。 -
第9题:
原子序列是8的元素,在周期表中属第几周期,第几族?写出该元素的名称。
正确答案:第二周期、第六族、氧。 -
第10题:
元素在化合物中的最高氧化态不一定等于该元素在周期表中的族次。
正确答案:正确 -
第11题:
填空题超重元素的假说预言自然界中可存在原子序数为114号的稳定同位素298114X,试根据原子结构理论和元素周期律预测: (1)114X元素位于元素周期表第()周期()族,为()元素(金属、非金属)。 (2)写出该元素最高价氧化物及其对应水化物的分子式()、(),并估计后者为()(酸、两性、碱) (3)该元素与氯生成化合物的分子式()、()。正确答案: 七,IVA,金属,XO2,X(OH)4,碱,XCl2,XCl4解析: (1)每周期中含有的元素种类分别是2、8、8、18、18、32、32,即第七周期如果全部排满,则最后一种元素的原子序数是118,所以114号元素位于第七周期ⅣA族。铅是金属,所以该元素也是金属。
(2)第ⅣA族也是的最高价是+4价,所以该元素最高价氧化物及其对应水化物的分子式分别是XO2、X(OH)4。同主族自上而下金属性逐渐增强,最高价氧化物的水化物的碱性逐渐增强,所以其氢氧化物是碱。
(3)第ⅣA族也是的主要化合价是+2价和+4价,因此该元素与氯生成化合物的分子式可以是XCl2、XCl4。 -
第12题:
单选题原子序数是标志元素在元素周期表中次序的序号,亦即是该元素原子()A核中的质子数
B核中的中子数
C核中的质子与中子数之和
D质量
正确答案: A解析: 暂无解析 -
第13题:
现代化学的元素周期律是l869年俄国科学家门捷列夫(DmitriMendeleev)首创的.他将当时已知的63种元素依相对原子质量大小并以表的形式排列.把有相似化学性质的元素放在同一列.制成元素周期表的雏形。经过多年修订后才成为当代的周期表。在周期表中,元素是以元素的原子序排列,最小的排行最先。表中一横行称为一个周期.一列称为一个族。某学生总结元素周期表的四个特征:①除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数;②除短周期外,其他周期均为18种元素;③副族元素没有非金属元素;④碱金属元素是指IA族的所有的元素。其中正确的是( )。A.只有①③
B.只有②③
C.只有③
D.只有③④答案:C解析:因为F元素没有正价,所以①错;第六周期含有32种元素,②错;副族全部是金属元素,③正确;氢元素是非金属,位于IA族,④错。 -
第14题:
某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。 下列叙述中哪一个不正确?A.外层电子排布为3d54s1
B.该元素为第四周期、ⅥB族元素铬
C. +3价离子的外层电子排布式为3d2s1
D.该元素的最高价氧化物的水合物为强酸答案:C解析:解:本题涉及核外电子排布与周期表的问题,根据题意,最高氧化数为+6的元素有ⅥA族和ⅥB族元素;而最外层只有一个电子的条件就排除了ⅥA族元素;最后一个条件是原子半径为同族中最小,可确定该元素是ⅥB族中的铬。Cr的电子排布式为1s22s22p63s23p63d54s1, 所以得出以下结论。
A正确。外层电子排布为3d54s1。
B正确。因为周期数等于电子层数,等于最高主量子数,即第四周期。它的量后一个电子填充在d亚层上,所以它是副族元素,而副族元素的族数等于[(n-1)d+ns]层上的电子数,对 铬来讲为5+1 = 6,即ⅥB族元素。
C错误。因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为3s23p63d3。
D正确。Cr的最高氧化物CrO3,其水合物为H2CrO4或H2Cr2O7均为强酸。
所以答案应为C。 -
第15题:
周期表中,主组元素所在族序数等于最外层电子数。
正确答案:正确 -
第16题:
如果发现了第121号元素M,则其所在周期表中的位置为()周期,()族;其金属活泼性较同族元素要()。
正确答案:第八;ⅢB;强 -
第17题:
某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。下列叙述中哪一个不正确()?
- A、外层电子排布为3d54s1
- B、该元素为第四周期、VIB族元素铬
- C、+3价离子的外层电子排布式为3d24s1
- D、该元素的最高价氧化物的水合物为强酸
正确答案:C -
第18题:
某元素位于周期表中36号元素之前,该元素失去2个电子以后,在角量子数l=2的轨道上正好半充满,试回答:该元素最高价氧化物水合物的分子式及酸碱性。
正确答案: Co(OH)3;碱 -
第19题:
某元素的价电子构型为3d54s1,则该元素在周期表中位于()
- A、三周期VB族
- B、三周期ⅥB族
- C、四周期VB族
- D、四周期ⅥB族
正确答案:D -
第20题:
某元素原子主量子数n为4的电子层上有7个电子,该元素原子外层电子构型是(),未成对电子数为(),原子核外电子分布式为(),该元素原子序数是(),它位于第()周期,第()族,最高氧化数()。
正确答案:4s24p5;1;1s22s22p63s23p63d104s24p5;35;四;ⅦA;+7 -
第21题:
已知某元素+3价离子的电子分布式为1s22s22p63s23p63d2,该元素在周期表中属于()。
- A、VB族
- B、ⅢB族
- C、VA族
- D、ⅢA族
正确答案:A -
第22题:
已知某元素为第四周期元素,其二价离子的外层有18个电子,则该元素的原子序数为(),元素符号为(),在周期表中的()区,第()族。
正确答案:20;Ca;S;ⅡA -
第23题:
单选题已知某元素+3价离子的电子分布式为1s22s22p63s23p63d2,该元素在周期表中属于()。AVB族
BⅢB族
CVA族
DⅢA族
正确答案: B解析: 暂无解析
