将8.4 g铁粉跟50 mL盐酸充分混合反应后,有固体剩余,同时收集到1.12 L(标准状况下)H2.原盐酸的物质的量浓度为____________mol/L.
题目
相似考题
更多“将8.4 g铁粉跟50 mL盐酸充分混合反应后,有固体剩余,同时收集到1.12 L(标准状况下)H2.原盐酸的物质的量浓度为____________mol/L.”相关问题
-
第1题:
将0.65g锌全部溶于200 mL稀盐酸中,然后加入80 mL 0.5 mol/L AgNO3溶液,恰好使Cl-沉淀完全。试计算:
(1)产生多少升(标准状况下)氢气。
(2)原稀盐酸的物质的量浓度为多少。答案:解析:
-
第2题:
0.62gNa2O恰好与20mL某浓度的盐酸完全反应,此盐酸的物质的量浓度为()(Na2O的相对分子质量为62)。
- A、1.0mol/L
- B、0.2mol/L
- C、0.4mol/L
- D、0.5mol/L
正确答案:A -
第3题:
500mL盐酸溶液中,含有纯盐酸的质量为36.5g,则此盐酸的物质的量浓度为()。
- A、0.5mol/L
- B、2mol/L
- C、3mol/L
- D、1.5mol/L
正确答案:B -
第4题:
37.23%的盐酸(HCL)密度为1.19g/cm2每升(1L=1000cm)盐酸溶液含量,盐酸的摩尔质量M为36.45G/mol,求在37.23%盐酸中每升含有盐酸的物质的量?
正确答案: 盐酸溶液含纯盐酸的质量为:
1.19g/cm3×1000cm3×37.23%=443.0g
求纯盐酸的物质的量为:
n=W/M=443.0g/36.45g/mol=12.15mol -
第5题:
取C(NaOH)=0.1020mol/L的氢氧化钠标准滴定溶液30.00ml,加50ml无CO2的蒸馏水及2滴酚酞指示液,用盐酸标准滴定溶液滴定,消耗盐酸30.52ml。同时量取50ml无CO2的蒸馏水做空白试验,消耗盐酸0.02ml,计算该盐酸溶液的物质的量浓度?
正确答案: C(NaOH)=0.1020mol/LVNaOH=30.00mlVHCl=30.52mlV空白=0.02ml
根据:C(NaOH)×VNaOH=C(HCl)×VHCl0.1020×30.00=C(HCl)×(30.52-0.02)C(HCl)=0.1020×30.0030.52-0.02mol/L=0.1003mol/L
盐酸溶液的物质的量浓度c(HCl)==0.1003mol/L。 -
第6题:
用标准的盐酸溶液来滴定待测NaOH溶液,已知盐酸溶液物质的量浓度为0.02mol/L,用量为20mL,待测NaOH溶液的用量为40mL,则NaOH溶液物质的量浓度为()。
- A、0.01mol/L
- B、0.02mol/L
- C、0.03mol/L
- D、0.05mol/L
正确答案:A -
第7题:
已知盐酸的质量浓度ρ(HCL)为90g/L,其物质的量浓度C(HCL)为()mol/L。(M(HCL)=36.5g/mol)
- A、3.15
- B、3.16
- C、2.40
- D、2.47
正确答案:D -
第8题:
将1L4mol/L氨水和1L2mol/L盐酸溶液混合,混合后OH-离子浓度为:()
- A、1mol/L
- B、2mol/L
- C、8.0×10-6mol/L
- D、1.8×10-5mol/L
正确答案:D -
第9题:
填空题将9.2gNa(摩尔质量23g/mol)和15gCl2(摩尔质量71g/mol)充分反应,所得NaCl的物质的量是(),将这些NaCl完全溶于500ml水中,所得溶液的物质的量浓度为()。正确答案: 0.4mol,0.8mol/l解析: 暂无解析 -
第10题:
单选题把80mLNaOH溶液加入到120mL盐酸中,所得溶液的pH值为2.如果混合前NaOH溶液和盐酸的物质的量浓度相同,它们的浓度是()A05mol/L
B01mol/L
C005mol/L
D1mol/L
正确答案: C解析: 暂无解析 -
第11题:
单选题物质的量浓度为C mol/L的盐酸V mL,加水稀释到2V mL,取出20mL,这20mL盐酸中含氯离子的物质的量为( ).A10C mol
B2C(2V-20)mol
C0.1C mol
D0.01C mol
正确答案: D解析:
稀释之后的溶液的物质的量浓度为0.5mol/L,因此20ml稀释后的溶液中氯离子的物质的量为0.01mol. -
第12题:
填空题将54.4g铁和氧化铁的混合粉末投入到适量的稀硫酸中,充分反应后收集到4.48L(标准状况下)氢气并测得溶液中既没有Fe3+也没有固体物质残留,则原混合粉末中铁和氧化铁的质量分别是____g和____g,反应中硫酸消耗掉____mol,反应后得到硫酸亚铁的物质的量是____mol.正确答案: 22.4,32,0.8,0.8解析:
由分析题意可知,最终剩余的铁和三价铁离子恰好完全反应.混合物中的铁的计算分为两部分,一部分是与稀硫酸反应生成氢气,另一部分是和三价铁离子(剩余部分的稀硫酸氧化铁全部转化为三价铁离子)完全反应,生成二价铁离子. -
第13题:
将6 mL 0.2 mol/L盐酸与10 mL 0.1 mol/L氨水混合,完全反应后,溶液中各种离子浓度的相对大小是.答案:解析: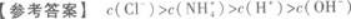 【解题指要】(1)首先要强调,将两种溶液混合时必须考虑这一过程中是否发生化学反应.如本题是将盐酸与氨水混合,会发生化学反应:
【解题指要】(1)首先要强调,将两种溶液混合时必须考虑这一过程中是否发生化学反应.如本题是将盐酸与氨水混合,会发生化学反应:

根据HCl和NH3的数量的不同.可能有三种情况:
①恰好完全反应,此时就变成NH4Cl溶液;
②HCl有剩余,此时就是NH4Cl和HCl的混合溶液;
③NH3有剩余,此时就是NH4Cl与NH3的混合溶液.
(2)盐酸中HCl的物质的量为:0.2 mol/L×0.006 L=0.001 2 mol.
氨水中NH3的物质的量为:0.1 mol/L×0.01 L=0.001 mol.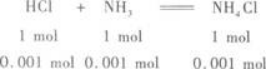
所以,反应后生成NH4Cl 0.001 mol,剩余的HCl为0.001 2 mol-0.001 mol=0.000 2 mol.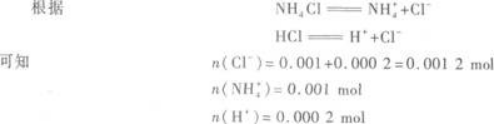
以上物质的量的大小顺序就是离子浓度的大小顺序.
另外,一般情况下,溶液均指水溶液,所以溶液中还有水电离出来的H+和OH-两种离子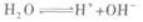
此题中酸有剩余,所以c(H+)一定大于c(OH-).
-
第14题:
欲配制1000ml 0.1mol∕L的HCl溶液,应量取浓盐酸(12mol∕L)HCl()毫升?
- A、0.84ml
- B、8.4ml
- C、1.2ml
- D、12ml
正确答案:B -
第15题:
在200mL稀盐酸里有0.73gHCI,则该溶液的物质的量浓度为()。
- A、0.1m0l/L
- B、0.2mOl/L
- C、0.5mOl/L
- D、1.0mOl/L
正确答案:A -
第16题:
计算题:若HCL的密度为1.183g/ml,含HCL量为37%,计算此盐酸的物质的量的浓度?(已知HCL的摩尔质量是36.45g/mol)
正确答案:解:1000ml盐酸溶液中含HCL的质量=1000×1.183×37%
CHCL=(1000×1.183×37%)/36.45=12mol/L -
第17题:
浓盐酸的密度1.198g/ml,含量36~38%,摩尔浓度18mol/l。
正确答案:错误 -
第18题:
用密度为1.19g/ml,质量百分浓度为38.32﹪的浓盐酸,配制10L0.1000mol/L的盐酸标准溶液,问需用上述浓盐酸多少毫升?已知:M(盐酸)=36.46g/mol
正确答案:要配制的盐酸标准溶液的摩尔数:10L×0.1000mol/L=1.000mol
已知M=36.46g/mol,
1.000×36.46=36.46g
36.46÷1.19÷38.32%=79.95ml
答:需要浓盐酸79.95毫升。 -
第19题:
将9.2gNa(摩尔质量23g/mol)和15gCl2(摩尔质量71g/mol)充分反应,所得NaCl的物质的量是(),将这些NaCl完全溶于500ml水中,所得溶液的物质的量浓度为()。
正确答案:0.4mol;0.8mol/l -
第20题:
将5mL10mol/L盐酸稀释为250mL溶液,再从稀释后的溶液中取出10mL溶液的摩尔浓度是().
- A、0.08mol/L
- B、0.2mol/L
- C、0.5mol/L
- D、1mol/L
正确答案:B -
第21题:
单选题1.06g Na2CO3跟20ml盐酸恰好完全反应,该盐酸的物质的量浓度为( ).A0.005mol/L
B1.00mol/L
C1.5mol/L
D2.00mol/L
正确答案: C解析:
1.06g碳酸钠的物质的量为0.01mol,与盐酸恰好反应系数比为1:2,因此反应需要0.02mol盐酸,可得盐酸的物质的量浓度为1mol/L. -
第22题:
单选题向200mL0.1mol/L Na2SO4溶液中加入100mL0.25mol/L的Ba(OH)2溶液后,还需加入多少盐酸才能恰好完全中和( ).A10mL lmol/L盐酸
B5mL lmol/L盐酸
C50mL lmol/L盐酸
D25mL 0.5mol/L盐酸
正确答案: A解析:
Ba(OH)2溶液加入后对氢氧根离子没有消耗,所以溶液中的氢氧根离子的物质的量为为0.05mol,所以需要0.05mol的氢离子来中和. -
第23题:
单选题盐酸的分子量是36.5,比重是1.19,浓度是36%,取盐酸10ml,加HO至100ml,盐酸浓度是多少()。A0.17mol/L
B0.36mol/L
C11.9mol/L
D1.17mol/L
E36.5mol/L
正确答案: D解析: 物质量浓度换算成摩尔浓度。
