元素X、Y、Z都位于短周期,它们的原子序数按X、Y、Z的顺序依次增大。X和Z位于同一主族,Y和Z位于同一周期。Y的单质与2的单质相互作用,生成离子化合物Y2Z。则X原子的结构示意图为__________。Y2Z的电子式为__________。
题目
相似考题
参考答案和解析

更多“元素X、Y、Z都位于短周期,它们的原子序数按X、Y、Z的顺序依次增大。X和Z位于同一主族,Y和Z位于同一周期。Y的单质与2的单质相互作用,生成离子化合物Y2Z。则X原子的结构示意图为__________。Y2Z的电子式为__________。”相关问题
-
第1题:
同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是:
A.单质的化学活泼性:W<X<Y<Z B.原子最外层电子数:W<X<Y<Z
C.单质的氧化能力:W<X<Y<Z D.元素的最高化合价:W<X<Y<Z
正确答案:B
-
第2题:
下列程序将x、y和z按从小到大的顺序排列,横线处应添加语句()。templatevoid fun (______) 下列程序将x、y和z按从小到大的顺序排列,横线处应添加语句( )。 template<class T> void fun (______) { T a; if(x>y) { a=x;x=y;y=a; } if(y>z) { a=y;y=z;z=a; } if(x>y) { a=x;x=y;y=a; } }
A.Tx,Ty,Tz
B.Tx;y;z
C.T&x,T&y,T&z
D.T&x,&y,&z
正确答案:C
解析:函数fun的类型为void没有任何返回值,函数中变量的改变,即参数的改变应该影响实参。应该是地址传递方式,即把引用型作为函数形参。类T是类的抽象,可以利用模板建立各种数据类型的类。所以补全函数的定义为“T &x,T &y,T &z”。 -
第3题:
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
正确答案:D
-
第4题:
元素X、Y、Z均为短周期元素,且原子序数依次增大.在一定条件下,X能跟Y化合,生成无色无味的气态物质XY2.0.1 mol Z的单质跟足量盐酸反应,生成2.24 L(标准状况下)氢气.则XY2的化学式为____________,Y的原子结构示意图为____________,Z的元素符号是____________.答案:解析: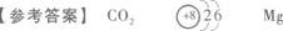 【解题指要】 (1)X、Y为短周期元素,能相互化合生成无色无味的气态物质XY2.首先考
【解题指要】 (1)X、Y为短周期元素,能相互化合生成无色无味的气态物质XY2.首先考
虑符合XY2形式的气体只有CO2、SO2和NO2.其中,NO2有色又有味,SO2无色但有刺激性气味,只有CO2无色无味.所以X为C元素,Y为O元素.
(2)Z的单质与盐酸反应,可生成氢气.所以Z必是金属元素.用M表示该金属,并设其化
合价为x,可写出Z与盐酸反应的化学方程式: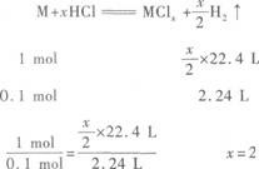
该金属为C、O元素之后的短周期元素,所以只能是Mg. -
第5题:
X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y:X和Z组成原电池时,Z为正极;Y和Z两种离子在同一溶液中被电解时.阴极只能得到Y单质:M离子的氧化性强于Y离子。则这四种金属的活动性由强到弱的顺序是:( )。A、X>Z>Y>M
B、X>Y>Z>M
C、M>Z>X>Y
D、X>Z>M>Y答案:A解析:金属活动性强的单质可以置换出金属活动性较弱的单质,X可以从Y的盐溶液中置换出Y,说明金属活动性X>Y;原电池中,负极金属的活动性较强,X和Z组成原电池时,Z为正极,说明金属活动性X>Z;电解池中。阴极是得电子被还原的一极,氧化性强的最先放电,Y和Z两种离子在同一溶液中被电解时.阴极只能得到Y单质,说明金属活动性Z>Y;M离子的氧化性强于Y离子,说明金属活动性Y>M。这四种金属的活动性顺序为X>Z>Y>M,本题选A。 -
第6题:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和2-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )。.A.原子的最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X>Y>z-
D.原子序数:X>Y>Z答案:D解析:由于x、Y、z均为短周期元素,Y+与z一的电子层结构相同,所以两种元素位于相邻周期,则Y是Na,Z是F,则X是S。原子最外层电子数F>S>Na,A项错误;单质沸点:Na>S>F:,B项错误;离子半径:S2->F>Na十,C项错误;原子序数:S>Na>F,D项正确。故选D。 -
第7题:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )。A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强答案:D解析:【知识点】元素周期表
【解析】由题意可知,X为碳,Y为氧,Z为镁,W为硅,则原子半径镁大于硅,A项错误;氧化镁为离子键,二氧化硅为共价键,B项错误;碳酸的酸性大于硅酸,C项错误;水的热稳定性大于硅烷.D项正确。故本题选D。 -
第8题:
短周期主族的非金属元素X、Y、Z在周期表中的位置如图所示,下列有关说法一定正确的是( )。 A、气态氢化物的稳定性:Z>Y>X
A、气态氢化物的稳定性:Z>Y>X
B、第一电离能:Z>Y>X
C、含氧酸的酸性:Z>Y>X
D、元素的最高化合价:Z=Y>X答案:A解析:同周期元素,从左到右,非金属性逐渐增强;同主族元素,从上到下,非金属性逐渐减弱。非金属性越强,气态氢化物越稳定,A项正确。若X是P,Y是S,Z是O,则第一电离能Z>X>Y,B项错误。若X是S,Y是Cl,Z是F,F没有含氧酸,F没有正化合价,C、D项错误。故本题选A。 -
第9题:
设X、Y、Z代表三种元素。已知: (1)X+和Y-两种离子具有相同的电子层结构; (2)Z元素原子核内质子数比Y元素原子核内质子数少9个; (3)Y和Z两种元素可以形成4核42电子的价阴离子。 据此,请填空: (1)Y元素是(),Z元素是()。 (2)由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是()。
正确答案:氯;氧;KClO4 -
第10题:
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是()。
- A、原子半径:Z>Y>X
- B、Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
- C、CaY2与水发生氧化还原反应时,CaY2只作氧化剂
- D、CaX2、CaY2和CaZ2,等3种化合物中,阳离子与阴离子个数比均为1:2
正确答案:B -
第11题:
单选题设平面∏位于平面x-2y+z-2=0和平面x-2y+z-6=0之间,且将二平面间的距离分成1:3,则∏之方程为( )。Ax-2y+z-5=0或x-2y+z-3=0
Bx+2y+z+8=0
Cx+2y-4z=0
Dx-2y+z-8=0
正确答案: A解析:
本题采用排除法较为简单。由于B、C两项所给出的平面方程的各项系数与已知平面不同,故它们与已知平面不平行,则可排除B、C项;D项平面与已知平面平行,但是不在两平面之间(可由常数项-8∉(-2,-6)判断出)。 -
第12题:
问答题合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:Y与Z形成的化合物的分子式是什么,该化合物中化学键的种类会是什么?正确答案: C.S2
极性键解析: 暂无解析 -
第13题:
下列程序将x、y和z按从小到大的顺序排列,请将下面的函数模板补充完整。templatevoid ord 下列程序将x、y和z按从小到大的顺序排列,请将下面的函数模板补充完整。
template<class T>
void order( )
{
T al
if(x>y)
{
a=x;x=y; y=a;
}
if(y>z)
{
a=y;y=Z; z=a;
}
if(x>y)
{
a=X;X=y; y=a;
}
}
正确答案:T&xT&yT&z。
T&x,T&y,T&z。 解析: 本题要填入的是函数的形参表,此函数的功能是:x、y和z按从小到大的顺序排列,那么就涉及到改变传入的实参值的情况,因此要采用引用传递的方式。所以本惠空白处应填入,T&x,T&y ,T&z。 -
第14题:
下面关于函数依赖的叙述中,正确的是( )。
Ⅰ.若X→Y,X→Z,则X→YZⅡ.若XY→Z,则x→Z,Y→Z
Ⅲ.若X→Y,WY→Z,则X→ZⅣ.若X→Y,Y→Y’,则X→Y’
 正确答案:B
正确答案:B
根据函数依赖的几个概念和Armstrong公理系统的推理规则来逐个判断。 -
第15题:
X、Y、Z是周期表中3种相邻的元素,X和Y同周期,Y和Z同主族.这3种元素原子的最外电子层中电子数的总和是17,核内质子数的总和是31,则X、Y.Z3种元素是下列各组中的( )A.N、O、S
B.O、S、P
C.O、F、Cl
D.C、Si、P答案:A解析: -
第16题:
X、Y、Z 3种金属,已知x可以从Y的盐溶液中置换出Y,X和Z作原电池电极时Z为正极,Y离子的氧化性强于Z离子,则这三种金属的活动性由强到弱的顺序是( )A.X>Y>Z
B.X>Z>Y
C.Z>X>Y
D.Z>Y>X答案:B解析:(1)根据“X可以从Y的盐溶液中置换出Y”,可知金属活动性是X>Y. (2)根据“X和Z作原电池电极时,Z为正极”和活泼金属作负极的判断依据,可知金属活动性是X>Z.
(3)“Y离子的氧化性强于Z离子.”根据金属活动性越强,其阳离子的氧化性越弱;金属活动性越弱,其阳离子的氧化性越强,可知金属活动性是Z>Y.
综上分析可得:X>Z>Y. -
第17题:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )。
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的简单气态氢化物的热稳定性比W强答案:D解析:由X、Y、Z、W的原子序数依次增大,x原子的最外层电子数是其内层电子数的2倍,可知X是C元素;Y是地壳中含量最高的元素,因此Y是0元素;Z2+和Y2-一具有相同的电子层结构,因此Z是Mg元素;W和X位于同主族,因此W是Si元素。A项,原子半径顺序应该是r(Z)>r(W)>r(X)>r(Y),A项错误;B项,Y与Z形成的化合物是M90,化学键是离子键,Y与W形成的化合物是Si02,化学键是共价键,B项错误;C项,同主族元素从上到下最高价氧化物对应的氧化物的酸性依次减弱.C项错误:D项,同周期元素对应的气态氢化物的稳定性从左到右依次增强,同主族的元素气态氢化物的稳定性从上到下依次减弱.故Y的简单气态氢化物的热稳定性比W的强.故D正确。 -
第18题:
X、Y、z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )。 答案:A解析:X、Y、Z均为短周期元素,Y+、Z-具有相同的电子层结构,说明Y位于2的下一周期,同时X、Y处于同一周期,X、Z的最低价离子分别为X2-、Z-,说明X是
答案:A解析:X、Y、Z均为短周期元素,Y+、Z-具有相同的电子层结构,说明Y位于2的下一周期,同时X、Y处于同一周期,X、Z的最低价离子分别为X2-、Z-,说明X是
-
第19题:
某化学老师在一次化学测验中设计了下列试题.并对部分学生的解题结果进行了统计和分析。
【试题】X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为Z2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )。
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
【考试结果】对参加考试的全体考生的答案情况统计如下:?
试根据上述信息,回答下列问题:?
(1)本题正确的选项是什么?
(2)请分析和诊断各个选项解答的错误原因。
(3)如果你要讲评本题,你教给学生的正确解题思路是什么?答案:解析:(1)D。
(2)对元素周期表不熟悉,不能根据题意推出X、Y、Z是什么元素。
(3)由X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-.Y+和Z-离子具有相同的电子层结构可推出,X、Y、Z分别为S、Na、F。所以原子最外层电子数Z>X>Y,单质的沸点为Y>X>Z.离子半径:X2->Z->Y+。 -
第20题:
短周期元素X、Y的原子序数相差6,下列有关判断错误的是()。
- A、X与Y可能位于同一周期或相邻周期
- B、X与Y可能位于同一主族或相邻主族
- C、X与Y可能形成离子化合物XY
- D、X与Y可能形成原子化合物XY2
正确答案:B -
第21题:
短周期元素分别为X、Y和Z,已知X元素的原子最外层只有1个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L层上的电子数比Y元素原子的L电子层上的电子数少2个,则三种元素所形成的化合物的分子式不可能是()
- A、X2YZ4
- B、XYZ3
- C、X3YZ4
- D、X4Y2Z7
正确答案:A -
第22题:
填空题X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件: ①元素周期表中,Z与Y相邻,Z与W也相邻; ②Y、Z和W三种元素的原子最外层电子数之和为17。 请填空: (1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):(),理由是()。 (2)Y是(),Z是(),W是()。 (3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式()。正确答案: 否,若同一周期左右相邻,则X-1+X+X+1=17,X为小数,O,N,S,名称为:硫酸铵,化学式为:(NH4)2SO4解析: 本题是一个相对比较简单,但又比较综合的元素周期律问题。主要涉及周期表中的元素位置关系,元素形成物质化学式确定,元素确定等问题。所要求的元素并没有超过短周期的要求。
根据条件(2),Y,Z,W最外层电子数之和为17,又Y与Z,Z与M均有相邻关系,短周期又必须是主族元素,故Z,Y,W的最外层电子数必可设为X,X,X+1或X,X,X-1有X+X+X+1=17或X+X+X-1=17,计算结果为:X=6,各元素最外层电子数为6,6,5且Z必为6。Y,Z,W原子序数依次增大,则电子层排布只能是Y:2,5,为N元素;Z:2,6,为O元素;W:2,8,6,为S元素。在根据X,Y,Z,W组成的化合物中各原子个数比为8:2:4:1,X必为化合价为1的H,形成的化合物为(NH4)2SO4。 -
第23题:
单选题短周期元素X、Y的原子序数相差6,下列有关判断错误的是()。AX与Y可能位于同一周期或相邻周期
BX与Y可能位于同一主族或相邻主族
CX与Y可能形成离子化合物XY
DX与Y可能形成原子化合物XY2
正确答案: C解析: A项,例如Na与Cl和Na与N,A项正确;B项,同族元素相差2、8、10、18,B项错误:C项,例如Na与Cl,C正确;D项,如SiO2,D项正确;故选B。
