对于给定的电极反应,标准电极电势jy的数值随温度而变。
题目
对于给定的电极反应,标准电极电势jy的数值随温度而变。
相似考题
参考答案和解析
更多“对于给定的电极反应,标准电极电势jy的数值随温度而变。”相关问题
-
第1题:
电对H+/H2,其电极电势随溶液的pH上升而;电对O2/OH-,其电极电势随溶液的pH上升而。
A、增加,增加
B、降低,降低
C、增加,降低
D、降低,增加
参考答案:B
-
第2题:
试验证实下列反应在标准条件下均按正方向进行( )。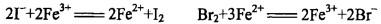
由此判断下列标准电极电势代数值从大到小的排列顺序正确的是( )。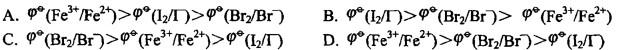 答案:C解析:
答案:C解析:
-
第3题:
改变电极反应式中计量数的倍数后,其电极电势的数值也将 随之改变
正确答案:错误 -
第4题:
平衡常数与温度的关系为dlnKø/dT=ΔrHmø/RT2,对于任一反应()
- A、Kø必然随温度升高而加大
- B、Kø必然随温度升高而减小
- C、Kø不随温度而变
- D、随温度升高Kø可增大、减小或不变
正确答案:D -
第5题:
电极电势代数值大的电对的氧化能力强。
正确答案:错误 -
第6题:
电解反应中,由于在阳极是电极电势较小的还原态物质先放电,在阴极是电极电势较大的氧化态物质先放电,所以阴极放电物质的电极电势必大于阳极放电物质的电极电势。
正确答案:错误 -
第7题:
电子热力学性质的规定,不包括下面哪一方面?()
- A、任何温度下标准氢电极的电极电位为0;
- B、标准氢电极的焓、熵、自由能变、热容变和电极电势为0;
- C、电子的所有热力学性质与温度无关;
- D、电子的生成热和生成吉布斯自由能为0
正确答案:C -
第8题:
pH值的改变可能改变电对的电极电势而不能改变电对的标准电极电势。
正确答案:正确 -
第9题:
(2006)标准电极电势是:()
- A、电极相对于标准氢电极的电极电势
- B、在标准状态下,电极相对于标准氢电极的电极电势
- C、在任何条件下,可以直接使用的电极电势
- D、与物质的性质无关的电极电势
正确答案:B -
第10题:
任何电对的电极电势的绝对值都不能直接测定,在理论上,某电对的标准电极电势E是将其与()电极组成原电池测定该电池的电动势而得到的。国际上规定上述电极的标准电极电势为()。
正确答案:标准氢;0.0000V -
第11题:
电解时,在阳极上首先发生氧化作用而放电的是()。
- A、标准还原电极电势最大者
- B、标准还原电极电势最小者
- C、考虑极化后,实际上的不可逆还原电极电势最大者
- D、实际析出电极电势最小者,首先在阳极上氧化放电而析出。
正确答案:D -
第12题:
单选题假设规定标准氢电极的电极电势φθ(H+/H2)=1V,则测得下列原电池:(-)Zn|Zn2+(1mol·dm-3)||H+(1mol·dm-3)|H2(pθ)(Pt)(+)的标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)的数值变化为()A标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)各增加1V
B标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)各减少1V
C标准电动势Eθ不变,锌标准电极电势φθ(Zn2+/Zn)增加1V
D标准电动势Eθ不变,锌标准电极电势φθ(Zn2+/Zn)减少1V
E标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)均不变
正确答案: E解析: 暂无解析 -
第13题:
标准电极电势是:
(A)电极相对于标准氢电极的电极电势
(B)在标准状态下,电极相对于标准氢电扱的电极电势
(C)在任何条件下,可以直接使用的电极电势
(D)与物质的性质无关的电极电势答案:B解析:点评:概念题。
-
第14题:
标准电极电势的值与反应的平衡常数的值一样与反应式的写法不同而不同
正确答案:错误 -
第15题:
标准电极电势的数值越小,其氧化型的氧化性越弱,其还原型的还原性越强
正确答案:正确 -
第16题:
电动势E的数值与电池反应的写法无关,而平衡常数Kθ的数值随反应式的写法而变。
正确答案:正确 -
第17题:
利用标准电极电势表判断氧化还原反应进行的方向,正确的是()
- A、氧化型物质与还原型物质起反应
- B、相应电极电势较高的氧化型物质与相应电极电势较低的还原型物质起反应
- C、氧化性强的物质与氧化性弱的物质起反应
- D、还原性强的物质与氧化性弱的物质起反应
正确答案:B -
第18题:
电极电势的数值与电池反应中化学计量数的选配及电极反应的方向无关,平衡常数的数值也与化学计量数无关。
正确答案:错误 -
第19题:
反应的平衡常数值随温度的升高而增大。
正确答案:正确 -
第20题:
条件电极电势是()
- A、标准电极电势;
- B、任意温度下的电极电势;
- C、任意浓度下的电极电势;
- D、电对的氧化型和还原型的浓度都等于1mol·L-1时的电极电势;
- E、在特定条件下,氧化型和还原型总浓度均为1mol·L-1时,校正了各种外界因素后的实际电极电势。
正确答案:E -
第21题:
为了测定电极的电极电势,需将待测电极与标准氢电极组成电池,这个电池的电动势就是待测电极电势的数值。按照目前惯用的电池符号书写方式和IUPAC对电极电势符号的规定, 待测电池符号应是()
- A、 (+)标准氢电极‖待测电极(-)
- B、 (-)待测电极‖标准氢电极(+)
- C、 (-)标准氢电极‖待测电极(+)
- D、 (+)待测电极‖标准氢电极(-)
正确答案:C -
第22题:
电池Pt|H2(0.1p9)|H+(aH+=1)||Cu2+|Cu的电动势()
- A、是铜电极的电极电势
- B、随aH+的增大而增大
- C、不因温度改变而改变
- D、不因向Cu2+溶液中加入NaCl而改变
正确答案:B -
第23题:
电极Pb2+(a)|Pb-Hg(a’)和Pb2+(a)|Pb(s)的电极电势和标准电极电势间的关系为:()。
- A、电极电势相同,标准电极电势不同
- B、标准电极电势相同,电极电势不同
- C、标准电极电势和电极电势均相同
- D、标准电极电势和电极电势均不同
正确答案:D -
第24题:
单选题标准电极电势是:()A电极相对于标准氢电极的电极电势
B在标准状态下,电极相对于标准氢电极的电极电势
C在任何条件下,可以直接使用的电极电势
D与物质的性质无关的电极电势
正确答案: C解析: 暂无解析
