下列叙述中正确的是()。A、向含有CaC03沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成B、向Na2C03溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的C02体积相同D、向Na2CO3饱和溶液中通入CO3,有NaHCO3结晶析出
题目
下列叙述中正确的是()。
- A、向含有CaC03沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
- B、向Na2C03溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2
- C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的C02体积相同
- D、向Na2CO3饱和溶液中通入CO3,有NaHCO3结晶析出
相似考题
更多“下列叙述中正确的是()。A、向含有CaC03沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成B、向Na2C03溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的C02体积相同D、向Na2CO3饱和溶液中通入CO3,有NaHCO3结晶析出”相关问题
-
第1题:
CO2中混有少量SO2杂质,除去SO2的方法最合理的是(??)A.通入水中
B.通入饱和Na2CO3溶液中
C.通入饱和NaHCO3溶液中
D.通入NaOH溶液中答案:C解析: -
第2题:
某无色透明溶液,仅由下列离子中的一种或几种组成,向该溶液中通入二氧化碳,有白色沉淀生成,滴加盐酸沉淀消失。若向溶液中滴入少量硝酸银亦会生成白色沉淀,加入硝酸沉淀不溶解,试分析下列离子中Ba2+、Fe3+、Cu2+、Cl-、CO2-3、NO-3,则溶液中一定存在的离子是______;一定不存在的离子是______;可能存在的离子是______。答案:解析:Ba2+、Cl-;
Fe3+、Cu2+、CO32-;
NO3-
溶液为无色透明,故一定不存在Fe3+、Cu2+,因为Fe3+为红褐色,Cu2+为蓝色;通入二氧化碳有白色沉淀生成,滴加盐酸后沉淀又消失,故推测一定存在Ba2+;生成的沉淀为碳酸钡白色沉淀,故溶液中一定没有CO32-;向溶液中滴入少量硝酸银,有白色沉淀生成,且加入硝酸沉淀不溶解,可推测出一定存在Cl-,生成白色沉淀为氯化银。 -
第3题:
Na2CO3溶液中滴加入BaCl2溶液,有BaCO3沉淀产生,能使此沉淀又溶解的物质是()。
- A、HCl
- B、NaCl
- C、Ba(OH)2
- D、Na2SO4
正确答案:A -
第4题:
用已知浓度的盐酸测定某Na2CO3溶液的浓度,若配制Na2CO3溶液时,所称取的Na2CO3中分别含有①NaOH;②NaCl;③NaHCO3;④K2CO3杂质时,所测结果偏低的是()。
- A、①
- B、①②
- C、①②③
- D、②③④
正确答案:D -
第5题:
现有一种含结晶水的淡绿色晶体,将其配成溶液,若加入BaCl2溶液,则产生不溶于酸的白色沉淀;若加入NaOH溶液,则生成白色胶状沉淀并很快变成红综色。再加入盐酸,此红综色沉淀又溶解,滴入硫氰化钾溶液显深红色。问该晶体是什么物质?
正确答案:A:FeSO4·7H2O -
第6题:
下列物质中,既能与盐酸反应,又能与NaOH溶液反应的是()
- A、Na2CO3;
- B、NaHCO3;
- C、NaHSO4;
- D、Na2SO4
正确答案:B -
第7题:
在进行沉淀的操作中,属于形成晶形沉淀的操作有()。
- A、在稀的和热的溶液中进行沉淀
- B、在热的和浓的溶液中进行沉淀
- C、在不断搅拌下向试液逐滴加入沉淀剂
- D、沉淀剂一次加入试液中
- E、对生成的沉淀进行水浴加热或存放
正确答案:A,C,E -
第8题:
一试液可能是NaOH、NaHCO3、、Na2CO3或它们的固体混合物的溶液。用20.00mL0.1000 mol·L-1HCl标准溶液,以酚酞为指示剂可滴定至终点。问在下列情况下,继以甲基橙作指示剂滴定至终点,还需加入多少毫升HCl溶液?第三种情况试液的组成如何? (1)试液中所含NaOH与Na2CO3、物质的量比为3∶1; (2)原固体试样中所含NaHCO3和NaOH的物质量比为2∶1; (3)加入甲基橙后滴半滴HCl溶液,试液即成重点颜色。
正确答案:(1)还需加入HCl为;20.00÷4=5.00mL
(2)还需加入HCl为:20.00×2=40.00mL
(3)由NaOH组成。 -
第9题:
向苯酚中滴入NaOH溶液后生成易溶于水的(),再通入CO2会出现(),因为又生成了()的苯酚,这说明苯酚酸性比碳酸()。
正确答案:苯酚钠;浑浊;难溶于水;弱 -
第10题:
一定温度下,在CaCO3饱和溶液中,加入Na2CO3溶液,结果降低了CaCO3的溶解度,这种现象称为()。
正确答案:同离子效应 -
第11题:
单选题已知在CaCO3饱和溶液中存在以下平衡:CaCO3(s)═══Ca2++CO32-。在此溶液中加入Na2CO3溶液,平衡将向哪个方向移动?()A向右
B向左
C不变
D反应停止
正确答案: A解析: 暂无解析 -
第12题:
单选题为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入( ).A无水CaCl2固体、水
B饱和NaHCO3溶液、浓H2SO4
C浓H2SO4、饱和Na2CO3溶液
D饱和Na2CO3溶液、稀H2SO4
正确答案: D解析:
A项,得到的气体不干燥;B项,通过饱和的碳酸氢钠除去带出来的氯化氢杂质,之后通过浓硫酸干燥气体,达到效果;C项,先通过浓硫酸得不到干燥的二氧化碳气体;D项,通过稀硫酸达不到干燥气体的目的. -
第13题:
将下列各组物质放入水中,生成白色沉淀,加入过量稀硝酸,则沉淀消失并有气泡产生,然后滴入AgN03溶液,又生成白色沉淀.则这组物质是( ) 答案:A解析:
答案:A解析: -
第14题:
向某溶液中加入过量盐酸生成白色沉淀,过滤后向滤液中加入过量的氨水(使溶液呈碱性).又有白色沉淀生成:再过滤后向滤液中加入碳酸钠溶液,又生成白色沉淀。则原溶液中含有的离子可能是()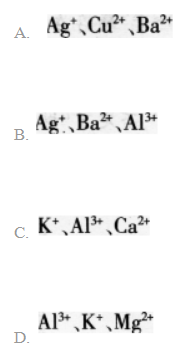 答案:B解析:
答案:B解析:
-
第15题:
有时需要降低钻井液中的钙离子浓度,常加入Na2CO3,使之生成CaCO3沉淀。
正确答案:正确 -
第16题:
一金属M与干燥的Cl2共热得一无色液体A,A与过量金属作用则转变为固体B.A的HCl水溶液通入H2S,则得黄色沉淀C,C可溶于(NH4)2S溶液生成化合物D,D的盐酸水溶液加入NaOH则生成沉淀,当NaOH过量,则沉淀溶解得溶液E,于E中加入铋(Ⅲ)盐,则有黑色固体F析出,试确定M和A→F各是什么物质
正确答案:MSn,A—SnCl4,B—SnCl2,C—SnS2,
D(NH4)2SnS3,E—Na2〔Sn(OH)4〕
F----Bi -
第17题:
写出下列各题的生成物并配平。 (1)Na2O2与过量冷水反应; (2)在Na2O2固体上滴加几滴热水; (3)在Na2CO3溶解中通入SO2至溶液的PH=5左右; (4)H2S通入FeCl3溶液中; (5)Cr2S3加水; (6)用盐酸酸化多硫化铵溶液; (7)Se和HNO3反应。
正确答案: (1)Na2O2+2H2O=H2O2+2NaOH;
(2)2Na2O2+2H2O=4NaOH+O2;
(3)Na2CO3+2SO2+H2O=2NaHSO3+CO2;
(4)H2S+2FeCl3=S+2FeCl2+2HCl;
(5)Cr2S3+H2O=Cr(OH)3+H2S;
(6)(NH4)2Sx+2HCl=2NH4Cl+(x-1)S+H2S;
(7)3Se+4HNO3+H2O=3H2SeO3+4NO。 -
第18题:
向某溶液中加入过量盐酸,生成白色沉淀,过滤后向滤液中加入过量氨水使溶液呈碱性,又有白色沉淀生成,在过滤后又向溶液中加入Na2CO3溶液,再次生成白色沉淀。原溶液中含有的离子是()()()
正确答案:Ag+;Al3+;Ba2+ -
第19题:
已知在CaCO3饱和溶液中存在以下平衡:CaCO3(s)═══Ca2++CO32-。在此溶液中加入Na2CO3溶液,平衡将向哪个方向移动?()
- A、向右
- B、向左
- C、不变
- D、反应停止
正确答案:B -
第20题:
A的水合物为紫色晶体。向A的水溶液中加入Na2CO3溶液有灰兰色沉淀B生成。B溶于过量NaOH溶液得到绿色溶液C。向C中滴加H2O2得黄色溶液D。取少量溶液D经醋酸酸化后加入BaCl2,溶液则析出黄色沉淀E。将D用硫酸酸化后通入SO2,得到绿色溶液F。将A的水溶液加入硫酸后加入KI溶液,经鉴定有I2生成,同时放出无色气体G。G在空气中逐渐变成棕色。给出A~G所代表的主要物质。
正确答案:A.Cr(NO3)3
B.Cr(OH)3
C.Cr(OH)4-
D.CrO42-
E.BaCrO4
F.Cr2(SO4)3
G.NO -
第21题:
某一化合物A溶于水得一浅兰色溶液。在A溶液中加入NaOH溶液可得浅兰色沉淀B。B能溶于HCl溶液,也能溶于氨水。A溶液中通入H2S,有黑色沉淀C生成。C难溶于HCl溶液而易溶于热浓的HNO3中。在A溶液中加入Ba(NO3)2溶液,无沉淀产生,而加入AgNO3溶液则有白色沉淀D生成,D溶于氨水。请给出A~D所代表的物质.
正确答案:A.CuCl2
B.Cu(OH)2
C.CuS
D.AgCl -
第22题:
用Na2CO3作基准物质来标定HCl溶液时,如果Na2CO3中含有少量NaHCO3,将会使HCl浓度的标定结果偏()
正确答案:大 -
第23题:
填空题有一包固体粉末,由下列物质中若干种均匀混合而成:Ba(NO3)2、CaCO3、Na2S、CuSO4、BaCl2,有关实验过程及记录如下:(1)将粉末溶于水,得到蓝色溶液和白色沉淀.过滤后将沉淀洗涤、烘干,称重质量为m克;(2)向滤出的沉淀中加入盐酸,沉淀不溶解;(3)把滤液分成三等份,第一份加稀HNO3和AgNO3溶液,无白色沉淀生成;第二份加入稀H2SO4,无明显现象:第三份加入过量Ba(NO3)2溶液,有白色沉淀生成,把沉淀滤出后洗涤,烘干,称重质量为m克.试判断此白色粉末由____混合而成,它们的物质的量之比为____.正确答案: Ba(NO3)2和CuSO4,1:4解析:
含Cu2+的溶液颜色为蓝色,粉末溶于水后得到蓝色溶液,则粉末中有CuSO4;既然含有CuSO4,则必然不含Na2S,否则两者之间会反应生成黑褐色沉淀CuS,由(2)知,粉末中不含有CaCO3;滤液加稀HNO3和AgNO3溶液,无白色沉淀生成,则溶液中不含有BaCl2;滤液加入稀H2SO4,无明显现象,说明沉淀过滤后,溶液中已经不含有Ba2+;由于粉末溶于水后得白色沉淀,则粉末中含有Ba(NO3)2.滤液加入过量的Ba(NO3)2溶液有白色沉淀生成,说明溶液中仍然含有SO42-,CuSO4是过量的,反应方程式为Ba(NO3)2+CuSO4=BaSO4↓+Cu(NO3)2,刚开始溶于水时产生白色沉淀BaSO4为m克,则各自消耗Ba(NO3)2和CuSO4一份,过滤后剩余的滤液分成三等份,其中一份加入过量Ba(NO3)2溶液,仍然有白色沉淀为m克,则滤液中含CuSO4三份,故Ba(NO3)2和CuSO4的物质的量之比为1:4.
