12、下列原电池中,其电池电动势与氯离子的活度无关的是()A.Zn∣ZnCl2(a1)‖KCl(a2)∣Hg2Cl2(s)∣HgB.Pt∣H2(p1)∣HCl(a)∣Cl2(p2)∣PtC.Hg∣Hg2Cl2(s)∣KCl(a)∣Cl2(p)∣PtD.Zn∣ZnCl2(a)∣Cl2(p)∣Pt
题目
12、下列原电池中,其电池电动势与氯离子的活度无关的是()
A.Zn∣ZnCl2(a1)‖KCl(a2)∣Hg2Cl2(s)∣Hg
B.Pt∣H2(p1)∣HCl(a)∣Cl2(p2)∣Pt
C.Hg∣Hg2Cl2(s)∣KCl(a)∣Cl2(p)∣Pt
D.Zn∣ZnCl2(a)∣Cl2(p)∣Pt
相似考题
更多“12、下列原电池中,其电池电动势与氯离子的活度无关的是()”相关问题
-
第1题:
下列电池的电动势与氯离子浓度无关的是。
A、(-)Zn|ZnCl2|Cl2|Pt(+)
B、(-)Zn|ZnCl2|KCl|AgCl|Ag(+)
C、(-)Ag|AgCl|KCl|Cl2|Pt(+)
D、(-)Pt|H2|HCl|Cl2|Pt(+)
参考答案:C
-
第2题:
向原电池 的负极中加入NaCl,则原电池电动势的变化是:
A.变大
的负极中加入NaCl,则原电池电动势的变化是:
A.变大
B.变小
C.不变
D.不能确定答案:A解析:提示:负极氧化反应:Ag+Cl-=AgCl+e
正极还原反应:Ag++e=Ag
电池反应为:Ag++Cl- = AgCl
由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,则电池的电动势增大。 -
第3题:
关于电动势,下列说法不正确的是哪个?()
- A、电动势的大小表明了电池反应的趋势
- B、电动势的大小表征了原电池反应所做的最大非体积功
- C、某些情况下电动势的值与电极电势值相同
- D、标准电动势小于零时,电池反应不能进行
正确答案:D -
第4题:
原电池电动势是原电池两极间的()。
- A、电位差
- B、最大电位差
- C、电流
- D、最大电流
正确答案:B -
第5题:
原电池工作时,体系的DG增大,而电动势E减小。
正确答案:正确 -
第6题:
电位分析法中,分析钾离子活度(pK值),依据的是()
- A、原电池电动势与K+浓度成线形关系
- B、原电池电动势与K+活度成线形关系
- C、原电池电动势与K+浓度对数成线形关系
- D、原电池电动势与K+活度对数成线形关系
正确答案:C -
第7题:
(2013)向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第8题:
在下列原电池中:(-)Zn│ZnSO4(1.0mol/L)‖C、uSO4(1.0mol/L)│C、u(+),如果降低Zn2+的浓 度,其电动势将()。
- A、增大
- B、减小
- C、不变
- D、无法判断
正确答案:A -
第9题:
下列电池的电动势与氯离子活度无关的是()
- A、Zn〡ZnCl2(aq)〡Cl2(p),Pt
- B、Zn〡ZnCl2(aq)〡KCl(aq)〡AgCl,Ag
- C、Ag-AgCl〡KCl(aq)〡Cl2(p),Pt
- D、Pt,H2(p)〡HCl(aq)〡Cl2(p),Pt
正确答案:C -
第10题:
单选题原电池电动势是原电池两极间的()。A电位差
B最大电位差
C电流
D最大电流
正确答案: C解析: 暂无解析 -
第11题:
单选题向原电池(-)Ag、的负极中加入NaCl,则原电池电动势变化是()。A变大
B变小
C不变
D不能确定
正确答案: D解析: 暂无解析 -
第12题:
单选题向原电池(-)Ag,AgCl|Cl-‖Ag+|Ag(+)的负极中加入NaCl,则原电池电动势的变化是( )。[2013年真题]A变大
B变小
C不变
D不能确定
正确答案: D解析:
原电池发生氧化还原反应,负极为:Ag-e-+Cl-=AgCl,正极为:Ag++e-=Ag。根据电极电势的能斯特方程式,有φ=φϴ+0.059lg[1/c(Cl-)]。由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,所以原电池的电动势E=φ正-φ负增大。 -
第13题:
将铜片插入盛有0.5mol•L-1的CuSO4溶液的烧杯中,银片插入盛有0.5mol•L-1的AgNO3溶液的烧杯中。 (1)写出该原电池的符号; (2)写出电极反应式和原电池的电池反应; (3)求该电池的电动势; (4)若加氨水于CuSO4溶液中,电池电动势如何变化?若加氨水于AgNO3溶液中,电池电动势又如何变化?(定性回答)参考答案:
-
第14题:
向原电池(-)Ag,AgCl Cl- Ag+ Ag(+)的负极中加入NaCl,则原电池电动势的变化是:A.变大
B.变小
C.不变
D.不能确定答案:A解析:提示 负极氧化反应:Ag+Cl- =AgCl+e
正极还原反应:Ag++e=Ag
电池反应为:Ag++Cl-=AgCl
原电池负极能斯特方程式为: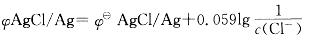
由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,
则电池的电动势增大。 -
第15题:
有两个原电池,测得其电动势相等,这表明两原电池中反应的△G0值也相等。
正确答案:错误 -
第16题:
在原电池中增加氧化态物质的浓度,电池电动势增加。
正确答案:错误 -
第17题:
直接电位法测定采用()电极和()电极构成原电池,然后测量原电池电动势,从而求得待测物质含量的。
正确答案:指示;参比 -
第18题:
向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第19题:
向原电池(-)Ag、的负极中加入NaCl,则原电池电动势变化是()。
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第20题:
对于原电池,极化的结果将使负极电势(),电池电动势()。
正确答案:升高;减小 -
第21题:
单选题(2013)向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()A变大
B变小
C不变
D不能确定
正确答案: D解析: 暂无解析 -
第22题:
问答题为什么原电池的端电压,正在工作的电解电池的外加电压都不等于相应可逆电池的电动势,其差值是如何形成的?正确答案: 内阻问题,无论是电解池还是原电池,由于电池存在内阻,电流通过电池将使原电池的电动势降低,电解池的外电压增大。只有当电池电流很小时,电极才能保持其平衡电极电位。解析: 暂无解析 -
第23题:
填空题直接电位法测定采用()电极和()电极构成原电池,然后测量原电池电动势,从而求得待测物质含量的。正确答案: 指示,参比解析: 暂无解析 -
第24题:
单选题电位分析法中,分析钾离子活度(pK值),依据的是()A原电池电动势与K+浓度成线形关系
B原电池电动势与K+活度成线形关系
C原电池电动势与K+浓度对数成线形关系
D原电池电动势与K+活度对数成线形关系
正确答案: B解析: 暂无解析
