2、粗盐提纯过程加入过量NaOH的目的是A.去除镁离子B.去除硫酸根离子C.去除氯化钡中的钡离子D.去除钙离子
题目
2、粗盐提纯过程加入过量NaOH的目的是
A.去除镁离子
B.去除硫酸根离子
C.去除氯化钡中的钡离子
D.去除钙离子
相似考题
参考答案和解析
更多“2、粗盐提纯过程加入过量NaOH的目的是”相关问题
-
第1题:
(3)粗盐提纯时蒸发滤液所用到的仪器是______________。
正确答案:
cdg -
第2题:
为了除去粗盐中的Ca2+、Mg2+.S042-及泥涉可将粗盐溶于不然后进行下列五项操作:①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2C03溶液⑤加过量BaCl2溶液。正确的操作顺序是( )。
A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.⑤②④①③
正确答案:CD
-
第3题:
通过海水晾晒可得粗盐。粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示。
根据以上信息回答:
(1)在完成操作Ⅰ之前,必须加入的X物质是( ) 。
(2)操作Ⅰ和操作Ⅱ的名称是( )。该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是( ) (填序号)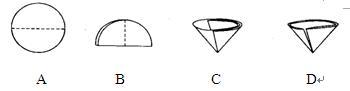
(3)在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取( )等措施。
(4)在实验过程中加入过量的NaOH溶液,其实验目的是( ) 。
(5)判断加入的盐酸“适量”的方法是( )。
(6)实验所得精盐的质量_________(填“大于”、“小于”或“等于”)粗盐中NaCl的质量,原因是( )。
答案:解析:(1)水
(2)过滤 D
(3)间歇加热(或“来回移动酒精灯或蒸发皿”)
(4)除尽溶液中的镁离子
(5)滴加盐酸至无气泡放出为止
(6)大于 提纯的过程中有氯化钠生成 -
第4题:
下列物质分离方法错误的是A、除去CO2中混有少量的CO:导出点燃
B、粗盐提纯的步骤:溶解→过滤→蒸发
C、除去H2中混有的HCl:将气体通过装有NaOH溶液的洗气瓶
D、除去铜粉中混有的CuO:用足量的稀硫酸浸泡后过滤、洗涤、答案:A解析: -
第5题:
用NaOH溶液滴定盐酸时,由于滴定速度太快,当混合溶液变红时不知NaOH是否过量,判断它是否过量的方法是()
- A、加入5mL盐酸再进行滴定
- B、返滴一滴待测盐酸
- C、重新进行滴定
- D、以上方法均不适用
正确答案:B -
第6题:
为了从粗盐(其中含K+、Ca2+、Mg2+、SO42-及泥沙等杂质)中提纯得到氯化钠,可将粗盐溶于水后,进行一系列操作。请将这些操作简要地写在下面空白处。
正确答案: A. 加过量BaCl2溶液并保持微沸一段时间
B. 过滤,弃去沉淀
C. 滤液加NaOH溶液调pH为11左右并加入Na2CO3溶液,然后煮沸一段时间
D. 过滤,弃去沉淀
E. 滤液中加HCl溶液中和至pH为4~5
F. 蒸发浓缩至稀糊状
G.冷却至室温,减压抽滤
H.将所得晶体放在蒸发皿中小火炒干 -
第7题:
一金属M与干燥的Cl2共热得一无色液体A,A与过量金属作用则转变为固体B.A的HCl水溶液通入H2S,则得黄色沉淀C,C可溶于(NH4)2S溶液生成化合物D,D的盐酸水溶液加入NaOH则生成沉淀,当NaOH过量,则沉淀溶解得溶液E,于E中加入铋(Ⅲ)盐,则有黑色固体F析出,试确定M和A→F各是什么物质
正确答案:MSn,A—SnCl4,B—SnCl2,C—SnS2,
D(NH4)2SnS3,E—Na2〔Sn(OH)4〕
F----Bi -
第8题:
为了除去粗盐中的Ca2+、Mg2+.S042-及泥涉,可将粗盐溶于不,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2C03溶液,⑤加过量BaCl2溶液。正确的操作顺序是()。
- A、①④②⑤③
- B、④①②⑤③
- C、②⑤④①③
- D、⑤②④①③
正确答案:C,D -
第9题:
现有四瓶绿色溶液,分别含有Ni(II)、Cu(II)、Cr(III)、MnO42- ⑴加水稀释后,溶液变蓝的是() ⑵加入过量酸性Na2SO3溶液后,变为无色的是() ⑶加入适量NaOH溶液有沉淀生成,NaOH过量时沉淀溶解,又得到绿色溶液的是() ⑷加入适量氨水有绿色沉淀生成,氨水过量时得到蓝色溶液的是()
正确答案:Cu(Ⅱ);MnO42-;Cr(III);Ni(Ⅱ) -
第10题:
粗盐提纯实验有几步操作?在各步操作中玻璃棒各起什么作用?
正确答案: 粗盐提纯的步骤是:①溶解;②过滤;③蒸发结晶.溶解时玻璃棒的作用是:搅拌,加速粗盐的溶解;过滤时玻璃棒的作用是:引流,使液体沿着玻璃棒流进过滤器,防止溅出.蒸发时玻璃棒的作用是:搅拌,使液体均匀受热,防止局部过热而溅出. -
第11题:
单选题一块镁铝合金溶于盐酸后,加入过量NaOH溶液,此时溶液中存在( ).AMgCl2
BNaAlO2
CAlCl3
DMg(OH)2
正确答案: A解析:
镁铝合金溶于盐酸后生成氯化镁和氯化铝,加入过量的NaOH溶液,会生成Al(OH)3与Mg(OH)2沉淀,Al(OH)3和NaOH会发生反应生成NaAlO2,Mg(OH)2不溶于NaOH,溶液中最终存在NaAlO2和NaCl. -
第12题:
填空题在甲基橙的制备中,使用对氨基苯磺酸内盐,首先需加入NaOH或者Na2CO3水溶液,其目的是()。正确答案: 对氨基苯磺酸内盐不溶于无机酸,很难重氮化,对氨基苯磺酸与碱作用成盐使氨基得以游离使重氮化反应容易进行解析: 暂无解析 -
第13题:
双硫腙单色法测定铅时,加入什么试剂将过量双硫腙去除
A.KCN-NH3溶液
B.NaOH-EDTA-2Na溶液
C.NaOH-NH3溶液
D.氯仿
E.四氯化碳
正确答案:D
-
第14题:
配制I2标准溶液时,加入KI的目的是( )和( )。用间接碘量法测铜时,加入过量KI的作用是( ),( ),( )。
正确答案:增大碘的溶解度;降低碘的挥发性;还原剂;沉淀剂;降低碘的挥发性及加快反应速度
-
第15题:
向含有HCI和FeCI3的混合溶液中,逐滴加入NaOH溶液至过量。下列图像正确的是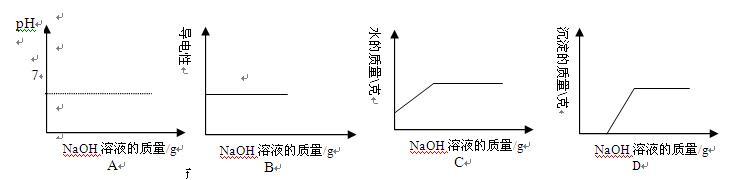 答案:D解析:
答案:D解析: -
第16题:
蛇纹石由MgO、A12O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是()
- A、沉淀X的成分是SiO2
- B、将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3
- C、在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
- D、溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
正确答案:B -
第17题:
小红同学在家做“粗盐提纯”的实验,下列对其做法的认识中,错误的是()
- A、将粗盐放入玻璃杯中加水溶解—粒子在不断运动
- B、溶解时用筷子搅拌——加快溶解速度
- C、用自制净水器过滤粗盐水——可将粗盐水变成纯净物
- D、实验时不用一次性塑料杯或纸杯——保护环境要从身边小事做起
正确答案:C -
第18题:
为了从粗盐(其中含K+、Ca2+、Mg2+、SO42-及泥沙等杂质)中提纯得到氯化钠,可将粗盐溶于水后,进行一系列操作。在提纯过程中,在加入相应试剂后,都会把溶液加热至微沸,并保持一段时间,为什么呢?
正确答案:增加离子碰撞机会使沉淀完全。 -
第19题:
既溶于过量氨水,又溶于过量NaOH溶液的是()
- A、Ca(OH)2
- B、Fe(OH)3
- C、Zn(OH)2
- D、Al(OH)3
正确答案:C -
第20题:
在某离子溶液中,加入过量的NaOH,先有白色沉淀产生,既而沉淀又消失,变得澄清的阳离子是()。
- A、K+
- B、Al3+
- C、Fe3+
- D、Mg2+
正确答案:B -
第21题:
有一种固体可能含有AgNO3,CuS、ZnCl2、KMnO4、K2SO4。固体加入水中,并用几滴盐酸酸化,有白色沉淀A生成,滤液B是无色的。白色沉淀A能溶于氨水。滤液B分成两份:一份加入少量NaOH时有白色沉淀生成,再加入过量NaOH时,沉淀溶解;另一份加入少量氨水时有白色沉淀生成,再加入过量氨水时,沉淀也溶解。根据上述实验现象,指出哪些物质肯定存在,哪些物质肯定不存在,哪些物质可能存在。
正确答案:肯定存在的:AgNO3、ZnCl2
肯定不存在的:KMnO4、CuS
可能存在的:K2SO4 -
第22题:
向FeCl3溶液中加入KSCN溶液后,溶液变为()色,再加入过量的NH4F溶液后,溶液又变为()色,最后滴加NaOH溶液时,又有()生成。
正确答案:血红;无;棕色Fe(OH)3沉淀 -
第23题:
单选题蛇纹石由MgO、A12O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是()A沉淀X的成分是SiO2
B将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3
C在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
正确答案: D解析: 暂无解析 -
第24题:
单选题小红同学在家做“粗盐提纯”的实验,下列对其做法的认识中,错误的是()A将粗盐放入玻璃杯中加水溶解—粒子在不断运动
B溶解时用筷子搅拌——加快溶解速度
C用自制净水器过滤粗盐水——可将粗盐水变成纯净物
D实验时不用一次性塑料杯或纸杯——保护环境要从身边小事做起
正确答案: B解析: 暂无解析
