PCl5的分解反应:PCl5(g) = PCl3(g) + Cl2(g),200℃达到平衡时有48.5%分解,300℃达到平衡时有97% 分解,则下列说法正确的是A.此反应为放热反应B.反应是吸热反应C.升高温度,平衡逆向移动D.压力改变对平衡无影响
题目
PCl5的分解反应:PCl5(g) = PCl3(g) + Cl2(g),200℃达到平衡时有48.5%分解,300℃达到平衡时有97% 分解,则下列说法正确的是
A.此反应为放热反应
B.反应是吸热反应
C.升高温度,平衡逆向移动
D.压力改变对平衡无影响
相似考题
更多“PCl5的分解反应:PCl5(g) = PCl3(g) + Cl2(g),200℃达到平衡时有48.5%分解,300℃达到平衡时有97% 分解,则下列说法正确的是”相关问题
-
第1题:
下列关于化学平衡的叙述中,错误的是()。A、当增加气体反应的总压力时,平衡向气体分子数增加的方向移动
B、化学平衡的影响因素有浓度、压力、温度、催化剂的种类
C、在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡的标志是:C生成的速率和C分解的速率相等
D、化学平衡是一种动态平衡
参考答案:A
-
第2题:
反应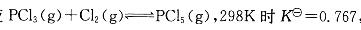 ,此温度下平衡时, 如p(PCl5)=p(PCl3),则p(C12)等于:
A. 130. 38kPa
,此温度下平衡时, 如p(PCl5)=p(PCl3),则p(C12)等于:
A. 130. 38kPa
B. 0. 767kPa
C. 7607kPa
D. 7. 67X10-3kPa答案:A解析: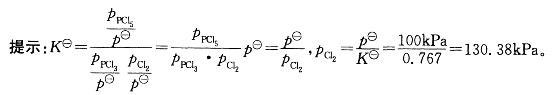
-
第3题:
反应 此温度下平衡时,如p(PCl5)=p(PCl3),则p(Cl2)等于:
A. 130. 38kPa
此温度下平衡时,如p(PCl5)=p(PCl3),则p(Cl2)等于:
A. 130. 38kPa
B. 0. 767kPa
C. 760 7kPa
D.7.67X10-3kPa答案:A解析: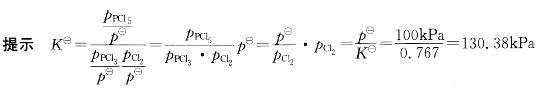
-
第4题:
在密闭容器中加热分解足量的NaHCO3(s),使其在较高温度下分解为Na2CO3(s),H2O(g)和CO2(g)。当反应达到平衡后,系统中共有()个相;若将系统中的Na2CO3(s)除去一部分,但仍保持分解平衡时的温度和压力,平衡将();若将系统中的NaHCO3(s)全部除去,其他条件不变时,系统处于()状态。
正确答案:3;不移动;非平衡 -
第5题:
氧化物分解反应在达到平衡时,气体产生的压力即称为分解压力,如果氧化物愈稳定,则分解压力()。
正确答案:愈小 -
第6题:
氧化物分解反应达到平衡时,产生气体的压力即为分解压力,如果分解压力越大,则氧化物越()。
- A、稳定
- B、不稳定
- C、无关系
正确答案:B -
第7题:
对反应PCl3(g)+Cl2(g)=PCl5(g),减小总压能提高PCl3/sub>的转化率。
正确答案:错误 -
第8题:
反应 PCl5(g) = PCl3(g) + Cl2(g),平衡时总压力为Pθ (Pa),离解率为50%。则此时的Kθ为()
- A、1
- B、1/2
- C、1/3
- D、1/4
正确答案:C -
第9题:
当反应PCl5(g)=PCl3(g)+Cl2(g)达平衡时,增大系统总压力,平衡()移动。
正确答案:向左 -
第10题:
已知分解反应NH2COONH4(s) = 2NH3(g) + CO2(g) 在30℃时的平衡常数K=0.000655,则此时NH2COONH4(s)的分解压力为:()
- A、16630Pa
- B、594000Pa
- C、5542Pa
- D、2928Pa
正确答案:A -
第11题:
下列反应中△rSm值最大的是()
- A、PCl5(g)→PCl3(g)+Cl2(g)
- B、2SO2(g)+O2(g)→2SO3(g)
- C、3H2(g)+N2(g)→2NH3(g)
- D、C2H6(g)+3.5O2(g)→2CO2(g)+3H2O(l)
正确答案:A -
第12题:
在给定温度和压力下发生的PCl5的分解反应,只须测定平衡时混合气体的密度就可以求知平衡常数了。
正确答案:正确 -
第13题:
氧化物分解反应达到平衡时,产生气体的压力称分解压。如果氧化物愈稳定则( )。
正确答案:分解压愈小
-
第14题:
对于可逆反应:PCl5(g)===PCl3(g)+Cl2(g),下列说法正确的是:( )A.恒温下,增大压力,由于产物分子数多,Kc值减小,平衡逆向移动
B.升高温度,反应速度加快,PCl5的分解率增大
C.减小总压力,反应速度减慢,PCl5转化率降低
D.降低温度,PCl5的分解率降低,此反应为吸热反应答案:D解析: -
第15题:
PCl5、PCl3、Cl2构成的体系中,如果存在如下化学反应PCl5(气)=PCl3(气)+Cl2(气)则该体系的组分数为2。
正确答案:正确 -
第16题:
在273℃时,向真空容器中引人五氯化磷,此时容器中压力为1atm 测得气体的密度为2.48g/L,试从这些数据计算PCl5(g)←→PCl3(g)+ Cl2(g)的Kp和Kc及各平衡物质的分压。
正确答案: Kp=3.3(atm); Kc=0.074(mol/L); Pc12=Ppc13=0.47atm; Ppc15=0.06atm. -
第17题:
氧化物分解反应达到平衡时,产生气体的压力即称分解压力,如果氧化物愈稳定则分解压愈小。
正确答案:正确 -
第18题:
氧化物分解反应达到平衡时,产生气体的压力即分解压力。如果氧化物愈稳定则分解压()。
正确答案:越小 -
第19题:
PCl5(g) = PCl3(g) + Cl2(g),在一定T和P下,若一定量的PCl5气体的体积为1升,此时PCl5气体已有50%分解为PCl3和 Cl2。若减少压力使体积变为2升,则PCl5的分解率将(),若保持压力不变,加入氦气,使体积变为2,则PCl5的分解率将()。(填“增大”、“减少”、“不变”)
正确答案:增大;增大 -
第20题:
PCl5的分解反应:PCl5(g)=PCl3(g)+Cl2(g),2000C达到平衡时有48.5%分解,3000C达到平衡时有97%分解。则下列说法正确的是()
- A、此反应为放热反应
- B、反应是吸热反应
- C、升高温度,平衡逆向移动
- D、压力改变对平衡无影响
正确答案:B -
第21题:
反应PCl3(g)+Cl2(g)PC5(g),在298K时,,此温度下平衡时,如p(PCl5)=p(PCl3),则p(Cl2)=()。
- A、130.38kPa
- B、0.767kPa
- C、7607kPa
- D、7.67×10-3kPa
正确答案:A -
第22题:
在250℃,PCl5全部气化,并能部分解离为PCl3(g)和Cl2(g)。将4.16gPCl5置于1.00L容器中,在250℃全部气化之后,测定其总压力为113kPa,那么其中包含的气体有();它们的分压是()。
正确答案:pPCl5=60.8kPa;pCl2=pPCl3=26.1kPa -
第23题:
当反应 PCl5(g) = PCl3(g) + Cl2(g) 达平衡时,加入惰性气体,但维持系统总压力不变,平衡()移动。
正确答案:向右 -
第24题:
单选题反应PCl3(g)+Cl2(g)PC5(g),在298K时,,此温度下平衡时,如p(PCl5)=p(PCl3),则p(Cl2)=()。A130.38kPa
B0.767kPa
C7607kPa
D7.67×10-3kPa
正确答案: A解析: 暂无解析
