符合新药报批人体生物利用度实验要求的叙述为A.生物利用度的计算结果只能由血药浓度得到B.不能用代谢产物求算生物利用度C.缓控释制剂的药动学参数除一般的外,还应提供可以描述缓控释制剂特殊释放行为的动力学参数D.生物等效性评价采用双单侧检验,对AUC和Cmax直接进行统计分析E.若受试制剂的AUC的95%.的可信限在标准参比制剂的95%.~105%.的范围内,可以认为两种制剂生物等效
题目
符合新药报批人体生物利用度实验要求的叙述为
A.生物利用度的计算结果只能由血药浓度得到
B.不能用代谢产物求算生物利用度
C.缓控释制剂的药动学参数除一般的外,还应提供可以描述缓控释制剂特殊释放行为的动力学参数
D.生物等效性评价采用双单侧检验,对AUC和Cmax直接进行统计分析
E.若受试制剂的AUC的95%.的可信限在标准参比制剂的95%.~105%.的范围内,可以认为两种制剂生物等效
相似考题
参考答案和解析
更多“符合新药报批人体生物利用度实验要求的叙述为A.生物利用度的计算结果只能由血药浓度得到B.不能用 ”相关问题
-
第1题:
符合生物利用度和生物等效性实验要求的选项为
A.生物利用度和生物等效性实验过程中,应当不禁水,受试者想喝多少喝多少
B.多次给药时,受试者只要在饭前服用受试药品即可
C.生物利用度和生物等效性实验只能采用男性健康志愿者,绝对不可以选用妇女、儿童或老年人
D.生物利用度和生物等效性实验的受试例数为18~24例,特殊情况必须采用100例以上
E.绝对生物利用度实验的参比制剂只要是注射剂即可
正确答案:D
-
第2题:
符合新药报批人体生物利用度实验要求的叙述为
A.在利用高效液相色谱法测定样品过程中,如果样品中内源性物质干扰样品的测定,但内源性物质的响应信号重复性较为一致,也可以认为该分析方法合理
B.对生物样品进行分析的精密度可以适当放宽,可以达到15%.,甚至20%.
C.对生物样品进行分析的回收率实验中,一般来说采用方法回收率和提取回收两种方法,但实际上两者的测定目的是一样的
D.对生物样品进行分析的稳定性实验可以不必考虑冻融实验
E.人体生物利用度实验追踪的物质必须为药物原型物质,不应追踪代谢产物或衍生化物
正确答案:B
-
第3题:
对于新药,进行人体生物利用度试验的制剂的要求是
A.试验制剂应是在符合GMB要求的环境下中试生产的产品
B.试验制剂应是在实验室条件下制备的小试样品
C.在进行绝对生物利用度实验时,参比制剂如果没有静脉注射剂则可以选用没有首过效应的制剂,例如:吸入制剂、直肠给药制剂等
D.进行相对生物利用度实验时,必须选用相同给药途径的制剂,如没有则可以选用实验室自制样品
E.进行相对生物利用度实验的样品不必经过国家药政主管部门批准
正确答案:A
-
第4题:
符合药物动力学实验研究的叙述为
A.不能用代谢产物求算生物利用度
B.表观分布体积是指人体体液具有的确切体积
C.多次给药的达稳态的时间由计算得到
D.AUC应当用梯形法计算得到
E.消除速度常数只能由静脉注射给药得到
正确答案:D
-
第5题:
以静脉注射给药为标准参比制剂求得的生物利用度称为A.相对生物利用度
B.绝对生物利用度
C.静脉生物利用度
D.参比生物利用度
E.生物利用度答案:B解析: -
第6题:
药物体内血药浓度消除一半所需要的时 间,称为
A.生物利用度
B.绝对生物利用度
C.相对生物利用度
D.溶出度
E.生物半衰期
答案:E解析: -
第7题:
药物体内血药浓度消除一半所需要的时间,称为 查看材料A.生物利用度
B.绝对生物利用度
C.相对生物利用度
D.生物等效性
E.生物半衰期答案:E解析: -
第8题:
试验制剂与参比制剂血药浓度一时间曲 线下面积的比值,称为
A.生物利用度 B.绝对生物利用度 C.相对生物利用度D.溶出度 E.生物半衰期答案:C解析: -
第9题:
试验制剂与参比制剂血药浓度一时问曲 线下面积的比值,称为
A.生物利用度
B.绝对生物利用度
C.相对生物利用度
D.溶出度
E.生物半衰期
答案:C解析: -
第10题:
以静脉注射制剂为参比制剂求得的生物利用度是A.静脉生物利用度
B.相对生物利用度
C.绝对生物利用度
D.生物利用度
E.参比生物利用度答案:C解析:生物利用度可分为绝对生物利用度和相对生物利用度,以静脉注射制剂为参比制剂求得的生物利用度是绝对生物利用度,相对生物利用度则是剂型之间或同种剂型不同制剂之间的比较研究,一般是以吸收最好的剂型或制剂为参比标准,故本题答案选C。 -
第11题:
符合新药报批人体生物利用度试验要求的是()
- A、进行单次给药生物利用度研究时,除服药时饮用水外,试验期间不得再饮用水,以防止血药浓度波动
- B、进行单次给药生物利用度研究时,服药4小时后统一进食,用200~250ml的温水送服药物
- C、进行单次给药生物利用度研究时,实验前一天应当开始禁食(至少24小时),次日早晨随食物一起服用药物
- D、进行多次给药生物利用度研究时,药物和食物应当一同服用
- E、进行多次给药生物利用度研究时,食物应由受试者自行决定
正确答案:B -
第12题:
单选题关于利培酮的药动学特点,叙述正确的是()A口服后,吸收迅速、完全,生物利用度高
B口服后,吸收较慢,生物利用度低
C与氯氮平合并用药,利培酮血药浓度不受影响
D肝代谢少,利培酮血药浓度高
E利培酮本身具有较强的药理活性
正确答案: B解析: 暂无解析 -
第13题:
以静脉注射为标准参比制剂求得的生物利用度为( )。
A.绝对生物利用度
B.相对生物利用度
C.静脉生物利用度
D.生物利用度
E.参比生物利用度
正确答案:A
-
第14题:
符合新药报批人体生物利用度实验参数要求的叙述为
A.药物动力学参数均应由计算得到
B.AUC应当用积分方程计算得到
C.Cmax和Tmax应当使用实测值
D.双隔室模型的动力学参数α、β具有实际动力学意义
E.T1/2的数据不能由缓控释制剂的药动学数据得到
正确答案:C
-
第15题:
符合新药报批人体生物利用度实验设计要求的叙述为
A.生物利用度研究的用药剂量一般与临床用药剂量一致,但特殊情况可适当增加剂量
B.生物利用度研究的用药剂量必须按照高、中、低三个剂量分别进行研究,以考察剂量对生物利用度的影响
C.两个试验周期至少应间隔受试药物的2~3个半衰期.通常间隔1~2天
D.进行多次给药生物利用度研究时,确定稳态时间时应通过计算而得到
E.受试期间受试者因为身体较为虚弱,进餐应当多提供高脂肪、高蛋白食物
正确答案:A
-
第16题:
符合新药报批人体生物利用度实验要求的叙述为
A.选用测定样品必须为血浆
B.采样时间越长越好,最好应持续到测定时超出测定的灵敏度为止
C.取血时间点宜越密越好,以保证数据的真实可靠
D.总采样点最少不应少于10个,且分布要合理
E.采样点的分布只需照应到分布相和消除相即可
正确答案:D
-
第17题:
试验制剂与参比制剂血药浓度一时间曲线下面积的比值,称为A.生物利用度
B.绝对生物利用度
C.相对生物利用度
D.生物等效性
E.生物半衰期答案:C解析: -
第18题:
试验制剂与其静脉给药参比制剂的血药浓度-时间曲线下面积的比值,称为A.生物利用度
B.绝对生物利用度
C.相对生物利用度
D.生物等效性
E.生物半衰期答案:B解析:本组题考查常用药物动力学参数。(1)生物半衰期:体内药量或血药浓度消除一半所需要的时间。(2)生物利用度:药物吸收进入血液循环的程度与速度。(3)相对生物利用度:试验制剂与参比制剂血药浓度-时间曲线下面积的比值。(4)绝对生物利用度:试验制剂与其静脉给药参比制剂的血药浓度-时间曲线下面积的比值。(5)生物等效性:是指含有相同活性物质的两种药品药剂学等效或药剂学可替代,并且它们在相同摩尔剂量下给药后,生物利用度(速度和程度)落在预定的可接受限度内,即两种制剂具有相似的安全性和有效性。 -
第19题:
关于生物利用度的叙述错误的是A.生物利用度系指制剂中的药物被吸收进入血液的速度和程度
B.试验制剂与参比制剂血药溶度-时间曲线下面积的比值为相对生物利用度
C.血药浓度-时间曲线下的面积(AUC)可全面反映药物的生物利用度
D.常用达峰时间(t )来比较制剂间的吸收快慢
)来比较制剂间的吸收快慢
E.当参比制剂为静脉注射剂时,其血药浓度-时间曲线下面积的比值称为绝对生物利用度答案:C解析:本题考点是生物利用度的概念及生物利用度的评价指标。生物利用度是指药物吸收进入血液循环的程度与速度。生物利用度包括两方面的内容:生物利用程度与生物利用速度。生物利用程度:即药物进入血液循环的多少。可通过血药浓度-时间曲线下的面积表示。试验制剂与参比制剂的血药浓度-时间曲线下面积的比率称为相对生物利用度。当参比制剂是静脉注射剂时,则得到的比率为绝对生物利用度。生物利用速度:即药物进入体循环的快慢。生物利用度研究中,常用血药浓度达到峰浓度(C )的时间(t
)的时间(t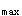 )比较制剂中药物吸收的快慢。制剂的生物利用度应该用C
)比较制剂中药物吸收的快慢。制剂的生物利用度应该用C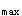 、t
、t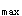 和AUC三个指标全面评价。所以选择C。
和AUC三个指标全面评价。所以选择C。 -
第20题:
A.生物利用度
B.绝对生物利用度
C.相对生物利用度
D.体内总清除率
E.生物半衰期试验制剂与其静脉给药参比制剂的血药浓度-时间曲线下面积的比值,称为答案:B解析:本题考点是药物动力学相关参数的定义。零级速度过程系指药物的转运速度在任何时间都是恒定的,与血药浓度无关,临床上恒速静脉滴注的给药速度以及控释制剂中药物的释放速度等为零级速度过程亦称零级动力学过程;体内总清除率或清除率是指单位时间内从机体或器官能清除掉相当于多少体积的血液中的药物;表观分布容积是体内药量与血药浓度间关系的一个比例常数;描述药物转运(消除)快慢的动力学参数是速度常数。试验制剂与参比制剂的血药浓度-时间曲线下面积的比率称为相对生物利用度,试验制剂与静脉给药参比制剂的血药浓度-时间曲线下面积的比率称为相对生物利用度。 -
第21题:
药物体内血药浓度消除一半所需要的时间,称为A.生物利用度
B.绝对生物利用度
C.相对生物利用度
D.生物等效性
E.生物半衰期答案:E解析:本组题考查常用药物动力学参数。(1)生物半衰期:体内药量或血药浓度消除一半所需要的时间。(2)生物利用度:药物吸收进入血液循环的程度与速度。(3)相对生物利用度:试验制剂与参比制剂血药浓度-时间曲线下面积的比值。(4)绝对生物利用度:试验制剂与其静脉给药参比制剂的血药浓度-时间曲线下面积的比值。(5)生物等效性:是指含有相同活性物质的两种药品药剂学等效或药剂学可替代,并且它们在相同摩尔剂量下给药后,生物利用度(速度和程度)落在预定的可接受限度内,即两种制剂具有相似的安全性和有效性。 -
第22题:
下列有关生物利用度的描述正确的是A.生物利用度主要是指药物吸收的速度
B.生物利用度主要是指药物吸收的程度
C.绝对生物利用度以静脉注射剂为参比制剂
D.相对生物利用度可用于比较同一品种不同制剂的优劣
E.生物利用度一般是用血药浓度-时间曲线下的面积(AUC)计算吸收的数量答案:A,B,C,D,E解析:根据药物吸收测定和临床观察,发现有些药物剂量相同,药物效应并不相同,药物含量不是决定疗效的唯一标准。除药物含量外还应考虑与吸收比率和吸收速率的有关问题,即生物利用度。
由血浆浓度--时间数据来评定生物利用度通常涉及三个参数:最大(峰)血浆药物浓度,达到最大血浆药物浓度的时间(达峰时间)和血浆浓度--时间曲线下面积。
绝对生物利用度是以静脉给药制剂(通常认为静脉给药制剂的生物利用度为100%)为参比制剂所获得的试验制剂,中药物吸收进入体循环的相对量,以血管外给药口服、肺部、经皮、肌内注射给药等的试验制剂与静脉注射的参比制剂给药后的AUC比值来表示,反映了给药途径对药物吸收的影响,主要取决于药物的结构与性质 。
药物制剂的生物利用度测定,一般是用非血管途径给药(如口服,op)的药-时曲线下的面积(AUC)与该药参比制剂如静注(iv) 或相同途径给药(po) 后的比值,以吸收百分率表示。根据试验试剂(t)和参比试剂(r) 给药途径的异同,可分为绝对生物利用度和相对生物利用度。加之,考虑到剂量可能不同,故其计算通式如下:
绝对生物利用度: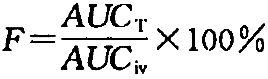
相对生物利用度: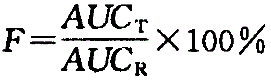
-
第23题:
下列关于生物利用度的叙述错误的是()
- A、生物利用度系指药物被吸收进入血液循环的速度和程度
- B、常用达峰时间(tmax)来比较制剂间的吸收快慢
- C、血药浓度-时间曲线下的面积(AUC)可全面反应药物生物利用度
- D、试验制剂与参比制剂血药浓度-时间曲线下面积的比值,为相对生物利用度
- E、当参比制剂为静脉注射剂时,其血药浓度-时间曲线下面积的比值称为绝对生物利用度
正确答案:E
