新药申报资料项目中有关稳定性研究的试验资料表述错误的是A.包括原料药的稳定性实验B.药物制剂处方与工艺研究中稳定性实验C.包装材料稳定性与选择D.药物制剂的加速实验与长期实验E.药物制剂产品上市后不需要进行稳定性考察
题目
B.药物制剂处方与工艺研究中稳定性实验
C.包装材料稳定性与选择
D.药物制剂的加速实验与长期实验
E.药物制剂产品上市后不需要进行稳定性考察
相似考题
更多“新药申报资料项目中有关稳定性研究的试验资料表述错误的是”相关问题
-
第1题:
在药物稳定性试验中,有关加速试验叙述正确的是
A.为新药申报临床与生产提供必要的资料
B.原料药需要此项试验,制剂不需此项试验
C.供试品可以用一批原料进行试验
D.供试品按市售包装进行试验
E.在温度(40±2)℃、相对湿度(75±5)%的条件下放置3个月
正确答案:AD
-
第2题:
下列说法错误的是
A、研究者在临床试验前必须获得药品监督管理部门批准进行临床试验的批文
B、研究者在临床试验前必须获得药检部门对准备用于人体试验的该批新药的质量检验合格证明
C、研究者在临床试验前必须熟悉申办者所提供的与临床试验有关的资料与文献
D、研究者在临床试验前必须审查全部研究资料
E、参加研究的医师不需要掌握研究计划内容与要求
参考答案:E
-
第3题:
化学药品注册申报资料项目10质量研究工作的试验资料及文献资料包括
A.纯度检查
B.剂型选择
C.工艺流程
D.含量测定
E.方法学验证
正确答案:ADE
-
第4题:
新药申请注册的程序除新药生产申请外,还有的是
A、新药临床试验申请
B、资料申报
C、技术审评
D、初查和现场核查
E、省级药品监督管理部门的形式审查
参考答案:A
-
第5题:
申报新药时必须报送的药理、毒理研究资料有:①主要药效学试验资料;②一般药理试验资料;③急性毒性,长期毒性试验资料;④致突变,致癌试验资料等。A.①+②+③+④
B.①+②+③
C.①+③
D.③+④
E.以上均不正确申报Ⅰ类新药须报送的资料有答案:A解析: -
第6题:
新药研究中制剂稳定性试验有哪些?
正确答案: 新药研究中制剂的稳定性试验有影响因素实验(高温实验、高湿实验、强光实验)、加速实验和长期实验。 -
第7题:
申报资料项目表中的"±"指的是()
- A、可以免报的资料
- B、可以用文献综述代替试验资料
- C、必须报送的资料
- D、按照说明的要求报送资料
- E、按照附件的要求报送资料
正确答案:B -
第8题:
新药进行临床试验必须提供()
- A、系统药理研究数据
- B、急、慢性毒性观察结果
- C、新药作用谱
- D、LD50
- E、临床前研究资料
正确答案:E -
第9题:
新药申报资料项目中有关稳定性研究的试验资料表述错误的是()
- A、包括原料药的稳定性实验
- B、药物制剂处方与工艺研究中稳定性实验
- C、包装材料稳定性与选择
- D、药物制剂的加速实验与长期实验
- E、药物制剂产品上市后不需要进行稳定性考察
正确答案:E -
第10题:
多选题新药研究中,稳定性研究一般包括()A影响因素试验
B加速试验
C长期试验
D药品上市后的稳定性研究
E稳定性评价
正确答案: D,A解析: 暂无解析 -
第11题:
单选题新药申报资料项目中有关稳定性研究的试验资料表述错误的是()A包括原料药的稳定性实验
B药物制剂处方与工艺研究中稳定性实验
C包装材料稳定性与选择
D药物制剂的加速实验与长期实验
E药物制剂产品上市后不需要进行稳定性考察
正确答案: E解析: 新药申报资料项目中需要报送稳定性研究的试验资料应包括了原料药的稳定性实验、药物制剂处方与工艺研究中稳定性实验、包装材料稳定性与选择、药物制剂的加速实验与长期实验、药物制剂产品上市的稳定性考察,以及药物制剂处方或生产工艺、包装材料改变后的稳定性研究。所以答案为E。 -
第12题:
单选题新药进行临床试验必须提供()A系统药理研究数据
B急、慢性毒性观察结果
C新药作用谱
DLD50
E临床前研究资料
正确答案: A解析: 暂无解析 -
第13题:
新药进行临床试验必须提供()
A.系统药理研究数据
B.新药作用谱
C.临床前研究资料
D.LD50
E.急慢性毒理研究数据
正确答案:C
-
第14题:
新药申请注册的程序包括新药生产申请和
A、新药临床试验申请
B、资料申报
C、技术审评
D、初查和现场核查
E、省级药品监督管理部门的形式审查
参考答案:A
-
第15题:
新药生产申请资料申报时,申请人完成药物临床试验后,应当填写《药品注册申请表》,向所在地省、自治区、直辖市药品监督管理部门报送申请生产的申报资料,并同时向中国药品生物制品检定所报送
A、样品的原材料
B、样品的研究资料
C、标准品的原材料
D、标准物质的研究资料
E、标准品的原材料及有关标准物质的研究资料
参考答案:E
-
第16题:
新药申请注册的两大程序除新药生产申请外还包括A:新药临床试验申请
B:资料申报
C:技术审评
D:初查和现场核查
E:省级药品监督管理部门的形式审查答案:A解析: -
第17题:
新药进行临床试验必须提供A.系统药理研究数据
B.急慢性毒性观察结果
C.新药作用谱
D.LD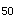
E.临床前研究资料答案:E解析: -
第18题:
下面说法错误的为()
- A、每一位受试者在试验中的有关资料均应记录于预先按试验要求而设计的病例报告表中。
- B、每一受试者在试验中的有关资料只记录在病历中。
- C、研究者在临床试验开始后,按临床试验的具体情况决定记录数据的方式。
- D、研究者只需将每一受试者在试验中的有临床意义的资料记录在病例报告表中。
正确答案:B,C,D -
第19题:
新药研究中,稳定性研究一般包括()
- A、影响因素试验
- B、加速试验
- C、长期试验
- D、药品上市后的稳定性研究
- E、稳定性评价
正确答案:A,B,C,D -
第20题:
下列有关药物制剂稳定性研究意义描述错误的是()
- A、药物制剂的基本要求是安全、有效、稳定
- B、药物制剂稳定性系指药物在体内的稳定性
- C、考察药物制剂稳定性可减少生产的经济损失
- D、制剂产品从原料合成、剂型设计到制剂生产都要进行稳定性研究
- E、新药申请必须呈报有关稳定性资料
正确答案:B -
第21题:
单选题申报资料项目表中的"±"指的是()A可以免报的资料
B可以用文献综述代替试验资料
C必须报送的资料
D按照说明的要求报送资料
E按照附件的要求报送资料
正确答案: E解析: 暂无解析 -
第22题:
问答题新药研究中制剂稳定性试验有哪些?正确答案: 新药研究中制剂的稳定性试验有影响因素实验(高温实验、高湿实验、强光实验)、加速实验和长期实验。解析: 暂无解析 -
第23题:
单选题下列有关药物制剂稳定性研究意义描述错误的是()A药物制剂的基本要求是安全、有效、稳定
B药物制剂稳定性系指药物在体内的稳定性
C考察药物制剂稳定性可减少生产的经济损失
D制剂产品从原料合成、剂型设计到制剂生产都要进行稳定性研究
E新药申请必须呈报有关稳定性资料
正确答案: B解析: 药物制剂最基本的要求是安全、有效、稳定。药物制剂在生产、贮存、使用过程中,会因各种因素的影响发生分解变质,从而导致药物疗效降低或副作用增加,有些药物甚至产生有毒物质,也可能造成较大的经济损失;通过对药物制剂稳定性的研究,考察影响药物制剂稳定性的因素及增加稳定性的各种措施,预测药物制剂的有效期,从而既能保证制剂产品的质量,又可减少由于制剂不稳定而导致的经济损失;此外,为了科学地进行处方设计,提高制剂质量,保证用药的安全、有效,我国在《药品注册管理办法》中对新药的稳定性也极为重视,规定新药申请必须呈报稳定性资料。 -
第24题:
单选题申报五类中药新药制剂,不需报送的资料是( )。A主要药效学试验
B一般药理试验
C急性毒性试验
D长期毒性试验
E致突变试验
正确答案: A解析:
申报五类中药新药制剂,不需报送致突变试验的资料。
