已知CaCO3和PbI2的溶度积均约为1X10-9,两者在水中的溶解度分别为S1和S2。下列二者的关系中正确的是哪一个? A. S12 B.2S1=S2 C. S1>S2 D.S1≈S2
题目
B.2S1=S2
C. S1>S2
D.S1≈S2
相似考题
更多“已知CaCO3和PbI2的溶度积均约为1X10-9,两者在水中的溶解度分别为S1和S2。下列二者的关系中正确的是哪一个? ”相关问题
-
第1题:
下列关系代数运算中,哪一个是不正确的?
A.σF(S1∩S2)=σF(S1)∩σF(S2)
B.πP(S1∩S2)=πP(S1)∩πP(S2)
C.σF(S1∪S2)=σF(S1)∪σF(S2)
D.πP(S1∪S2)=πP(S1)∪πP(S2)
正确答案:B
解析:选择是单目运算,其运算对象是一个表。该运算按给定的条件,从表中选出满足条件的行形成一个新表作为运算结果。投影也是单目运算,该运算从表中选出指定的属性值组成一个新表。连接把两个表中的行按着给定的条件拼接而形成的新表。 -
第2题:
已知CaCO3和PbI2的溶度积均约为1X10-9,两者在水中的溶解度分别为S1和S2。下列二者的关系中正确的是哪一个?
A. S12 B.2S1=S2C. S1>S2 D.S1≈S2答案:A解析:提示:CaCO3属于AB型,PbI2属于AB2型难溶电解质。其溶解度与溶度积之间的关系分别为:
-
第3题:
两组测得值分别为1001、1002、1003、1004、1005和0.1001、0.1002、0.1003、0.1004、0.1005,其标准差分别为S1和S2,两者之间的关系是()。
- A、S1=S2
- B、S1>S2
- C、S1=S2/10000
- D、S1=10000S2
正确答案:D -
第4题:
已知CaCO3和PbI2的溶度积均约为1×10-9,两者在水中的溶解度分别为S1和S2。下列二者的关系中正确的是哪一个?()
- A、S12
- B、2S1=S2
- C、S1>S2
- D、S1≈S2
正确答案:A -
第5题:
用水稀释含有大量CaCO3固体的水溶液时,CaCO3的溶度积(),溶解度(), 溶解量()。
正确答案:不变;不变;增多 -
第6题:
简述溶度积和溶解度的关系?
正确答案: 溶度积表示难溶解电解质在一定温度下溶解能力的大小,对于同类型难溶电解质,溶度积小者其溶解度也小,可以说沉淀的溶度积是反映沉淀溶解度的标志,两者之间具有内在的相互联系,可以用溶解度求它的溶度积,反过来可以根据溶度积求溶解度。 -
第7题:
下列等式中,哪一个是不正确的?()
- A、S1∩(S2∩S3)≡(S1∩S2)∩S3
- B、πA(S1∩S2)≡πA(S1)∩πA(S2)
- C、σF(S1∩S2)≡σF(S1)∩σF(S2)
- D、πA(S1∪S2)≡πA(S1)∪πA(S2)
正确答案:C -
第8题:
下列叙述中正确*的是()
- A、难溶电解质离子浓度的乘积就是该物质的溶度积
- B、溶度积大者,其溶解度就大
- C、溶液中组成难溶电解质的离子积大于它的溶度积时,就会产生沉淀
- D、用水稀释含有AgCl 固体的溶液时,AgCl的溶度积不变,其溶解度增大
正确答案:C -
第9题:
PbI2和CaCO3的溶度积均近似为10-9,从而可知在他们的饱和溶液中,前者的Pb2+浓度与后者的Ca2+浓度近似相等。
正确答案:错误 -
第10题:
设AgCl在水中,在0.01mol·L-1CaCl2中,在0.01mol·L-1NaCl中以及在0.01mol·L-1AgNO3中的溶解度分别为S0,S1,S2,S3这些量之间的定量关系正确的是()。
- A、S0>S1>S2>S3
- B、S0>S2>S1>S3
- C、S0>S2=S3>S1
- D、S3>S0>S2>S1
正确答案:C -
第11题:
单选题下列各种叙述中正确的是()?A难溶电解质离子浓度的乘积就是该物质的溶度积
B溶度积大,其溶解度就大
C用水稀释有AgCl固体的溶液时,AgCl的溶度积不变,但其溶解度增加
D溶液中组成难溶电解质的离子积大于它的溶度积时就产生沉淀
正确答案: B解析: 一定温度下,难溶电解质饱和溶液中离子浓度(带方次)的乘积为该物质的溶度积。在任意条件下的乘积为离子积。当离子积大于溶度积时就产生沉淀。 -
第12题:
单选题设AgCl在水中、0.01mol·l-1CaCl2、0.01mol·l-1NaCl中以及在0.05mol·l--1AgNO3中的溶解度分别为S0、S1、S2、S3,这些量之间的正确关系是()。AS0>S1>S2>S3
BS0>S2>S1>S3
CS0>S1=S2>S3
DS0>S2>S3>S1
正确答案: B解析: 暂无解析 -
第13题:
设 AgCl 在水中、在0. 01mol/L NaCl 溶液中、在0. 01mol/L MgCl2 溶液中、在0. 01mol/L AgNO3溶液中的溶解度分别为S0、S1、S2、S3。下列式子中正确的是?
A. S0>S3>S2>S1 B. S0>S1=S3>S2
C. S0>S1>S2>S3 D. S0>S1=S2=S3答案:B解析:提示:AgCl在NaCl、MgCl2、AgNO3溶液中均存在同离子效应,使溶解度下降,而0. 01mol/L的MgCl2溶液中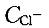 为0. 02mol/L,故溶解度下降更多。
为0. 02mol/L,故溶解度下降更多。 -
第14题:
AgCl在水中,0.01mol/L CaCl2 溶液中,0.01mol/L NaCl溶液,0.05mol/L AgNO3 溶液中的溶解度分别为S0、S1、S2、S3,那么下列哪种排列是正确的( )。
A. S0>S1>S2>S3 B. S0>S2>S1>S3 C. S0>S1>S2=S3 D. S0>S2>S3>S1答案:B解析:提示:据同离子效应,同离子浓度越大,溶解度越低。 -
第15题:
两组测得值分别为1001、1002、1003、1004、1005和1、2、3、4、5,其标准差分别为S1和S2,两者之间的关系是()。
- A、S1=S2
- B、S1>S2
- C、S1
D、S1=S2/1000
正确答案:A -
第16题:
已知AgCl,Ag2S的溶度积依次为2×10-1,6×10,它们在水中的溶解度分别是()和()
正确答案:1.4×10mol·L;8.4×10-17mol·L -
第17题:
以下选项中说法正确的是()
- A、溶度积小的物质一定比溶度积大的物质溶解度小
- B、对同类型的难溶物,溶度积小的一定比溶度积大的溶解度小
- C、难溶物质的溶度积与温度无关
- D、难溶物的溶解度仅与温度有关
正确答案:B -
第18题:
两组测得值分别为1001、1002、1003、1004、1005和0.1001、0.1002、0.1003、0.1004、0.1005,其标准差分别为S1和S2,两者之间的关系是()。
- A、S1=S2
- B、S1﹥S2
- C、S1=S2/10000
- D、S1=10000S2
正确答案:D -
第19题:
天然水中各种矿物质的溶解度和沉淀作用遵守溶度积原则。
正确答案:正确 -
第20题:
如何区分溶解度和溶度积的概念?
正确答案:溶解度是在一定温度下饱和溶液中溶解的固体质量除以溶剂质量所得的商,是个量纲为一的量。溶度积指平衡状态下难溶电解质溶液中离子浓度的乘积。 -
第21题:
PbI2和CaCO3的溶度积均近似为10-9,从而可知它们的饱和溶液中,前者的Pb2+浓度与后者的Ca2+浓度近似相等。
正确答案:错误 -
第22题:
单选题已知CaCO3和PbI2的溶度积均约为1×10-9,两者在水中的溶解度分别为S1和S2。下列二者的关系中正确的是哪一个?()AS12
B2S1=S2
CS1>S2
DS1≈S2
正确答案: D解析: 暂无解析 -
第23题:
判断题天然水中各种矿物质的溶解度和沉淀作用遵守溶度积原则。A对
B错
正确答案: 对解析: 暂无解析
