两种元素的原子按一定比例相结合,具有新的晶体结构,在晶格中各元素原子的相互位置是固定的,称为()。A化合物B铁素体C机械混合物D固溶体
题目
A化合物
B铁素体
C机械混合物
D固溶体
相似考题
参考答案和解析
略
更多“两种元素的原子按一定比例相结合,具有新的晶体结构,在晶格中各元素原子的相互位置是固定的,称为()。”相关问题
-
第1题:
A、B、C为短周期元素,它们在元素周期表中的位置关系如图1-8所示.已知B、C两元素原子序数之和是A元素原子序数的4倍.则A元素的符号为____________,C元素的原子结构示意图为____________.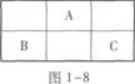 答案:解析:【解题指要】 根据A、B、C在元素周期表中的位置(如图1-16所示)可知,A位于第二周期,B、C位于第三周期.所以,若设A元素的原子序数为x,则B、C两元素的原子序数分别为(x+7)和(x+9).
答案:解析:【解题指要】 根据A、B、C在元素周期表中的位置(如图1-16所示)可知,A位于第二周期,B、C位于第三周期.所以,若设A元素的原子序数为x,则B、C两元素的原子序数分别为(x+7)和(x+9).
根据题意得:(x+7)+(x+9)=4x,即x=8.
由此可知A是8号元素氧,其元素符号是O,B是15号元素磷,C
-
第2题:
两种元素的原子按照一定比例相结合,但并不改变各自的晶体结构,在晶格中各元素原子的相互位置是固定的,叫化合物。
A对
B错
错
略 -
第3题:
溶质原子置换了溶剂晶格中某些结点位置上的溶质原子而形成的固溶体,称为()。
正确答案:置换固溶体 -
第4题:
两种元素的原子按一定比例相结合,具有新的晶体结构,在晶格中各元素原子的相互位置是固定的,称为()。
- A、化合物
- B、铁素体
- C、机械混合物
- D、固溶体
正确答案:A -
第5题:
固溶体按溶质原子在晶格中位置可分为()、()。
正确答案:间隙固溶体;置换固溶体 -
第6题:
两种元素的原子半径大小差别愈大,形成固溶体后所引起的晶格扭曲程度()。
- A、不变
- B、越小
- C、越大
正确答案:C -
第7题:
元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。请回答下列问题:(1)有人说“氦的最外层电子数为2,应该把它放在第ⅡA族”,你认为这样编排元素周期表有何利弊?(2)结合化学教学实践,论述三序结合的原则在化学教材编写中“原子结构和元素周期表”理论部分的应用。
正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知和心理发展过程和知识体系;理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。 -
第8题:
两种元素的原子按一定比例相结合,具有新的晶体结构,在晶格中各元素原子的相互位置是固定的,叫化合物。通常化合物具有较高的硬度,低的塑性,()也较大。
- A、强度
- B、脆性
- C、韧性
- D、延伸率
正确答案:B -
第9题:
判断题两种元素按一定的原子数比例化合,形成与元素晶格类型及性质完全不同的复合体,在晶格中各元素原子的相互位置是固定的,称为化合物。A对
B错
正确答案: 错解析: 暂无解析 -
第10题:
单选题两种元素的原子按一定比例相结合,具有新的晶体结构,在晶格中各元素原子的相互位置是固定的,称为()。A化合物
B铁素体
C机械混合物
D固溶体
正确答案: D解析: 暂无解析 -
第11题:
填空题晶体结构中由原子或原子集团组成的最小重复单元称为(); 由晶格(点阵)的三个平移基矢围成的平行六面体称为()。正确答案: 基元,晶胞解析: 暂无解析 -
第12题:
单选题关于电负性含义错误的是()。A元素的原子在分子中吸引电子的能力称为电负性
B同周期元素从左到右,电负性随着原子序数增加逐渐变大
C同族元素从上到下,随着原子半径的减小而减小
D同族元素从上到下,随着原子半径的增大而减小
正确答案: B解析: 元素的电负性是指原子在分子中吸引电子的能力。鲍林指定F的电负性为4.0,并通过对比一次求出其他元素的电负性。电负性的数值是相对的。 -
第13题:
某一种晶格上的原子部分被另一种元素的原子所取代,称为间隙固溶体。
A对
B错
错
略 -
第14题:
若组成固溶体的两种组元,其原子直径差别较少,且在周期表中的位置相互靠近,晶格类型相同,则这些组元能以任意比例互相溶解,这种固溶体被称为()固溶体。
- A、间隙
- B、置换
- C、有限
- D、无限
正确答案:D -
第15题:
两种元素的原子按照一定比例相结合,但并不改变各自的晶体结构,在晶格中各元素原子的相互位置是固定的,叫化合物。
正确答案:错误 -
第16题:
硼族元素的原子都是()电子原子,在硼的化合物中,硼原子的最大配位数是()。硼和铝都是亲()元素。
正确答案:缺;4;氧 -
第17题:
某一种晶格上的原子部分被另一种元素的原子所取代,称为间隙固溶体。
正确答案:错误 -
第18题:
元素原子第一电离能的周期性变化规律及其原因是什么?原子的各原子参数之间相互有何区别和联系?
正确答案: 同一周期的元素,从左到右,第一电离能的总体变化趋势是逐渐减小,到每周期的最后一个元素稀有气体时,第一电离能的数值达到最大。这是由于同一周期元素,从左到右,电子层没有变化,核电荷逐渐增加,原子半径逐渐减小,核对外层电子的吸引力增强的结果。同一族的元素,自上而下,第一电离能的总体变化趋势是逐渐减小的,这是因为从上到下,电子层数增加,原子半径变大,有效核电荷减小,核对外层电子的吸引力减弱的原因。
原子参数常包含原子半径、有效核电荷、电离能、电子亲和能和电负性等,它们分别表示了原子性质的各个方面,但各原子参数在周期表中都呈现出一定的周期性变化规律,并且这些周期性变化规律都是由于原子内电子有规律性排布的结果。 -
第19题:
关于电负性含义错误的是()。
- A、元素的原子在分子中吸引电子的能力称为电负性
- B、同周期元素从左到右,电负性随着原子序数增加逐渐变大
- C、同族元素从上到下,随着原子半径的减小而减小
- D、同族元素从上到下,随着原子半径的增大而减小
正确答案:C -
第20题:
多选题构成匀晶合金的两种组元之间必须满足以下条件:()。A具有相同的晶体结构,晶格常数相近
B具有相同的熔点
C具有相同的原子价
D具有相似的电负性
E原子半径差小于15%
正确答案: D,B解析: 暂无解析 -
第21题:
单选题关于电负性的含义不正确的是()。A元素的原子在分子中吸引电子的能力称为电负性
B同周期元素从左到右,电负性随着原子序数增加逐渐变大
C同族元素从上到下,随着原子半径的减小而减小
D同族元素从上到下,随着原子半径的增大而减小
正确答案: B解析: 根据现有数据可以看出,活泼的非金属一般具有较高的电子亲合势,金属元素的电子亲合势都比较小。然而,最大的电子亲合势不是出现在每族的第二周期的元素,而是第三周期以下的元素。这是由于第二周期的非金属元素(如F、O等)的原子半径小,电子密度大,电子间排斥力大,以至于当结合一个电子形成负离子时,放出的能量减小。 -
第22题:
判断题两种元素的原子按照一定比例相结合,但并不改变各自的晶体结构,在晶格中各元素原子的相互位置是固定的,叫化合物。A对
B错
正确答案: 错解析: 暂无解析 -
第23题:
判断题两种元素的原子大小的差别越大,形成固溶体后引起的晶格扭曲的程度就越小。A对
B错
正确答案: 错解析: 暂无解析 -
第24题:
判断题某一种晶格上的原子部分被另一种元素的原子所取代,称为间隙固溶体。A对
B错
正确答案: 错解析: 暂无解析
