称取试样1.000g溶解,将其中的磷沉淀为磷钼酸铵,用20.00mL,0.1000mol·L-1NaOH溶解沉淀,过量的NaOH用0.2000mol·L-1HNO3,7.50mL滴至酚酞终点,计算试样中w(P)、w(P2O5)。 已知:
题目
称取试样1.000g溶解,将其中的磷沉淀为磷钼酸铵,用20.00mL,0.1000mol·L-1NaOH溶解沉淀,过量的NaOH用0.2000mol·L-1HNO3,7.50mL滴至酚酞终点,计算试样中w(P)、w(P2O5)。 已知: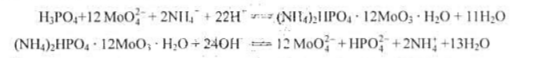
相似考题
更多“称取试样1.000g溶解,将其中的磷沉淀为磷钼酸铵,用20.00mL,0.1000mol·L<sup>-1</sup>NaOH溶解沉淀, ”相关问题
-
第1题:
称取磁铁矿试样0.2176g,经溶解后,将Fe3+沉淀为Fe(OH)3,经灼烧后称得m(Fe2O3)=0.1346g,求Fe3O4的质量分数。
正确答案:
-
第2题:
用减量法从称量瓶中称取0.4000g分析纯的NaOH固体,溶解后稀释到100mL,所得NaOH溶液的浓度为
A.小于0.1000mol/L
B.等于0.1000mol/L
C.大于0.1000mol/L
D.以上三种情况都有可能
小于 0.1000mol/L -
第3题:
20、制成BaSO4沉淀过程中,正确的操作是()
A.称取一定量的试样,加入离子水,搅拌溶解
B.称取一定量的试样,加入去离子水和一定浓度的HCl,搅拌溶解
C.两份试样可以用同一玻璃棒
D.玻璃棒可以从烧杯中取出
称取一定量的试样,加入去离子水和一定浓度的HCl,搅拌溶解 -
第4题:
某试样除Pb3O4外仅含惰性杂质,称取0.1000g,用盐酸溶解,加热下加入0.02mol·L-1K2Cr2O7标准溶液25.00ml,析出PbCrO4沉淀。冷却后过滤,将沉淀用盐酸溶解后加入淀粉和KI溶液,用0.1000mol·L-1Na2S2O3标准溶液滴定,消耗12.00mL。试样中Pb3O4的质量分数是多少?(Pb3O4分子量685.6)
D -
第5题:
称取CaCO3试样0.1600 g,加入浓度为0.1025 mol•L^-1的HCl标准溶液20.00 mL。煮沸除去CO2,用浓度为0.1012 mol•L^-1的NaOH标准溶液返滴定过量酸,消耗了10.24 mL NaOH溶液。计算试样中CaCO3的百分含量。
84.66
