4、已知300 K和100 kPa时, 1 mol×L-1 N2O4(g)按反应N2O4(g)= 2NO2 (g) 进行。达平衡时,有20 %N2O4分解为NO2,则此反应的Kθ值为()。A.0.27B.0.05C.0.20D.0.17
题目
4、已知300 K和100 kPa时, 1 mol×L-1 N2O4(g)按反应N2O4(g)= 2NO2 (g) 进行。达平衡时,有20 %N2O4分解为NO2,则此反应的Kθ值为()。
A.0.27
B.0.05
C.0.20
D.0.17
相似考题
更多“4、已知300 K和100 kPa时, 1 mol×L-1 N2O4(g)按反应N2O4(g)= 2NO2 (g) 进行。达平衡时,有20 %N2O4分解为NO2,则此反应的Kθ值为()。”相关问题
-
第1题:
若 298K 时反应N2O4 (g) = 2NO2(g) 的 Kө =0.1132,则当 N2O4 和 NO2 的分压均为1.0 kPa 时, 该反应()
A向生成 NO2 的方向进行
B向生成 N2O4 的方向进行
C正好达到化学平衡
D难于判断其进行方向
参考答案A
-
第2题:
已知2NO2(g)N2O4(g)(正反应放热),该反应达到平衡后,下列条件有利于反应向正方向进行的是( )。A.降低温度和增大压强
B.降低温度和减小压强
C.升高温度和减小压强
D.升高温度和增大压强
答案:A解析:其他条件不变的情况下,增大(减小)压强,化学平衡向着气体体积缩小(增大)的方向移动;温度升高(降低),会使化学平衡向着吸热(放热)反应的方向移动。该反应的正反应为放热、气体体积缩小的反应。故应降低温度和增大压强,正确答案为A选项。 -
第3题:
若298K时反应N2O4(g)=2NO2(g)的KΘ=0.1132,则当p(N2O4)=p(2NO2)=100kPa时,反应将()
- A、向生成N2O4的方向进行
- B、向生成NO的2方向进行
- C、正好达化学平衡状态
- D、难于判断其进行方向
正确答案:D -
第4题:
已知 2NO2(g) === 2NO(g)+O2(g)是基元反应,ΔrHmΘ为113 kJ·mol–1。其正反应的速率方程为(),当反应达到平衡时,升高温度平衡常数KΘ();降低压力,平衡()移动。
正确答案:v=k[c(NO2)]2;增大;右 -
第5题:
在一定温度下,将1.0molN2O4(g)放入一密闭容器中,当反应N2O4(g)↔2NO2(g)达到平衡时,容器内有0.8molNO2,气体总压为100.0kPa,则该反应的KΘ为()
- A、0.76
- B、1.3
- C、0.67
- D、4.0
正确答案:A -
第6题:
有化学反应:N2O4⇌2NO2-56.9KJ,该反应达到平衡后,增加N2O4的浓度,下列说法正确的是()。
- A、向生成N2O4的方向移动
- B、向生成NO2的方向移动
- C、不移动
- D、先向生成N2O4的方向移动,后向生成NO2的方向移动
正确答案:B -
第7题:
反应式N2O4→2NO2中,“→”表示()。
- A、可逆反应
- B、其中“→”为N2O4分解生成NO2
- C、不可逆反应
- D、其中“→”表示为NO2结合生成N2O4的逆反应
正确答案:A,B,D -
第8题:
已知298K时理想气体反应N2O4(g)→2NO2(g)的Kθ为0.1132。今在同温度且N2O4(g)及2NO2(g)的分压都为101.325kPa的条件下,反应将()
- A、向生成NO2的方向进行
- B、正好达到平衡
- C、难以判断其进行方向
- D、向生成N2O4的方向进行
正确答案:D -
第9题:
在298.15K和标准态时,下列反应均为非自发反应,其中在高温下仍为非自发反应的是()(不必计算)
- A、Ag2O(s) = 2Ag(s) + 1/2O2(g)
- B、N2O4(g) = 2NO2(g)
- C、Fe2O3(s) +3/2C(s) = 2Fe(s) +1/2CO2(g)
- D、6C(s) + 6H2O(g) = C6H12O6(s)
正确答案:D -
第10题:
在298K时N2O4(g)=2NO2(g)的Kø=0.142,当p(N2O4)=101.325kPa,p(NO2)=10.133kPa时,判断反应的方向为()
- A、Qa〈Kø,自发
- B、Qa〉Kø,非自发
- C、Qa=Kø,平衡
- D、Qa〈Kø,非自发
正确答案:A -
第11题:
若反应气体都是理想气体,反应平衡常数之间有Ka=Kp=Kx的反应是()①2HI(g)=H2(g)+I2(g)②N2O4(g)=2NO2(g)③CO(g)+H2O(g)=CO2(g)+H2(g)④C(s)+CO2(g)=2CO(g)
- A、(1)(2)
- B、(1)(3)
- C、(3)(4)
- D、(2)(4)
正确答案:B -
第12题:
单选题可逆反应N2O4(g)2NO2-Q达到平衡后,现有示意图:其中能够正确表示30℃和100℃时,平衡混合物中NO2的质量分数w(NO2)与压强(p)的关系是( ).ABCD正确答案: D解析:
温度不变时,增加压强,该反应向逆反应方向移动;压强不变时,升高温度,反应向正向移动. -
第13题:
恒温下,在反应2NO2(g)=N2O4(g)达到平衡后的体系中加入惰性气体,则平衡不移动。()
参考答案:错误
-
第14题:
当反应2NO2(g) N2O4(g)达到平衡时,降低温度混合气体的颜色会变浅,说明此反应的逆反应是( )。
N2O4(g)达到平衡时,降低温度混合气体的颜色会变浅,说明此反应的逆反应是( )。
A. 的反应 B.
的反应 B. 的反应
的反应
C. 的反应 D.气体体积减小的反应答案:B解析:提示:降低温度混合气体的颜色会变浅,说明NO2量减少,即降低温度平衡向正方向移动。根据温度对化学平衡的影响可知:降温平衡向放热(
的反应 D.气体体积减小的反应答案:B解析:提示:降低温度混合气体的颜色会变浅,说明NO2量减少,即降低温度平衡向正方向移动。根据温度对化学平衡的影响可知:降温平衡向放热(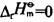 >0。
>0。 -
第15题:
若298K时反应N2O4(g)=2NO2(g)的Kq=0.1132,则当p(N2O4)=p(NO2)=100kPa时,反应将()
- A、向生成N2O4的方向进行
- B、向生成NO2的方向进行
- C、正好达化学平衡状态
- D、难于判断其进行方向
正确答案:A -
第16题:
在308K和总压1.013×105Pa,N2O4有27.2%分解为NO2。从计算结果说明压强对平衡移动的影响。
正确答案: 增大压强,平衡向体积减小的方向移动;
减小压强,平衡向体积增大的方向移动。 -
第17题:
有化学反应:N2O4=2NO2-56.9kJ,该反应达到平衡后,增加N204的浓度,下列说法正确的是()。
- A、向生成N2O4的方向移动
- B、向生成NO2的方向移动
- C、不移动
- D、先向生成N2O4的方向移动,后向生成NO2的方向移动
正确答案:B -
第18题:
有化学反应:千焦,该反应达到平衡后,增加N2O4的浓度,下列说法正确的是()。
- A、向生成N2O4的方向移动
- B、向生成NO2的方向移动
- C、不移动
- D、先向生成N2O4的方向移动,后向生成NO2的方向移动
正确答案:B -
第19题:
假设各反应中的气体都是理想气体,则Kø=Kp=Kx=Kn的反应是()
- A、CaCO3(s)=CaO(s)+CO2(g)
- B、N2O4(g)=2NO2(g)
- C、2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)
- D、CO(g)+H2O(g)=CO2(g)+H2(g)
正确答案:D -
第20题:
反应NO2(g)=NO(g)+ 1/2O2(g) 的Kθ=a 则反应: 2NO2(g)=2NO(g)+O2(g)的Kθ‘应为()
- A、a
- B、1/a
- C、a2
- D、√a
正确答案:C -
第21题:
恒温下,在反应2NO2(g)= N2O4(g)达到平衡后的体系中加入惰性气体,则()
- A、平衡向右移动
- B、平衡向左移动
- C、条件不充分,无法判断
- D、平衡不移动
正确答案:C -
第22题:
若反应气体都是理想气体,反应平衡常数之间有Ka=Kp=Kx的反应是:() (1)2HI(g)=H2(g)+I2(g); (2)N2O4(g)=2NO2(g); (3)CO(g)+H2O(g)=CO2(g)+H2(g); (4)C(s)+CO2(g)=2CO(g)
- A、(1)(2)
- B、(1)(3)
- C、(3)(4)
- D、(2)(4)
正确答案:B -
第23题:
单选题若298K时反应N2O4(g)=2NO2(g)的KΘ=0.1132,则当p(N2O4)=p(2NO2)=100kPa时,反应将()A向生成N2O4的方向进行
B向生成NO的2方向进行
C正好达化学平衡状态
D难于判断其进行方向
正确答案: A解析: 暂无解析 -
第24题:
单选题若298K时反应N2O4(g)=2NO2(g)的Kq=0.1132,则当p(N2O4)=p(NO2)=100kPa时,反应将()A向生成N2O4的方向进行
B向生成NO2的方向进行
C正好达化学平衡状态
D难于判断其进行方向
正确答案: A解析: 暂无解析
