某课外活动小组为探究实验室制取氢气的方案,分别用金属A、B跟质量相同、质量分数相同的稀硫酸反应,经实验发现:生成氢气的质量与反应时间有下图所示关系。 分析图像得到的以下结论中,不合理的是 A.反应得到氢气的质量相等 B.反应后所得溶液的质量分数A>B C.两种金属的活动顺序A>B D.稀硫酸已完全反应,两种金属可能有剩余
题目
分析图像得到的以下结论中,不合理的是

B.反应后所得溶液的质量分数A>B
C.两种金属的活动顺序A>B
D.稀硫酸已完全反应,两种金属可能有剩余
相似考题
更多“某课外活动小组为探究实验室制取氢气的方案,分别用金属A、B跟质量相同、质量分数相同的稀硫酸反应,经实验发现:生成氢气的质量与反应时间有下图所示关系。 ”相关问题
-
第1题:
将Mg;Al;Zn分别放入相同溶质质量分数的盐酸中,反应完全后,放出的氢气质量相同,其可能原因是( )
A.放入的三种金属质量相同,盐酸足量;
B.放入的Mg;Al;Zn的质量比为12:18:32.5,盐酸足量;
C.盐酸质量相同,放入足量的三种金属;
D.放入盐酸的质量比为3:2:1,反应后无盐酸剩余。
正确答案:C
-
第2题:
镁、锌、铁三种金属各30g,分别与足量盐酸反应,生成氢气的质量各是多少?如果反应后各生成氢气30g,则需要这三种金属的质量各是多少?
生成氢气的质量:Mg: 2.5g, Zn: 0.92g, Fe: 1.07g 需要金属的质量:Mg: 360g, Zn: 975g, Fe: 840g -
第3题:
一定质量的某铝屑和铁屑的混合物与足量稀硫酸反应后放出氢气8.96L(标准状况),同质量的此混合物与足量的氢氧化钠溶液反应,放出氢气6.72L(标准状况),求混合物中铝和铁的质量.答案:解析:题目中涉及的化学反应如下: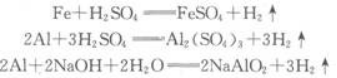

答:原混合物中铝的质量为5.4g,铁的质量为5.6g. -
第4题:
下面是某化学教师的教学实录片段:
提出问题:质量守·to_定律表明,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。如何设计实验加以证明
设计实验方案:学生经过独立思考和小组交流,形成实验方案。
评价实验方案:教师巡视并选取4个典型实验方案,让各小组评价方案的可行性,并全班交流,教师点评。
方案1:盐酸和碳酸钠粉末在烧杯中反应,称量并比较化学反应前后反应物与生成物的质量关系。
方案2:氯化钡溶液和硝酸钡溶液反应,称量并比较化学反应前后反应物与生成物的质量关系。
方案3:盐酸和氢氧化钠溶液反应,称量并比较化学反应前后反应物与生成物的质量关系。
方案4:氢氧化钠溶液和硫酸铜溶液反应,称量并比较化学反应前后反应物与生成物的质量关系。
根据上述教学实录片段,回答下列问题:
(1)分别判断上述4个方案的可行性,并说明理由。
(2)请分析学生设计出不可行方案的可能原因。
(3)从评价主体的角度分析,上述教学实录片段中采用了哪些评价方式答案:解析:(1)方案1:不可行。原因是盐酸和碳酸钠粉末在烧杯中反应会生成二氧化碳气体,气体会脱离反应体系,逸散到空气中.而二氧化碳的质量无法称量:导致反应前的质量比反应后的质量大。 方案2:不可行。氯化钡溶液和硝酸钡溶液不发生化学反应。
方案3:可行。盐酸和氢氧化钠溶液反应生成氯化钠和水,反应前后反应物与生成物的质量相等。
方案4:可行。氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠溶液,沉淀依旧存在体系中,可以称量.反应前后反应物与生成物的质量相等。
(2)不可行方案为l和2,其原因如下:
方案1:学生没有考虑到在烧杯中反应生成的二氧化碳气体会逸出,无法测量二氧化碳质量的问题。
方案2:学生可能忽略验证质量守恒定律的前提是要有化学反应发生,氯化钡溶液和硝酸钡溶液不发生化学反应.虽然一段时间后体系质量不变,但是并没有发生化学反应,所以方案不可行。
(3)从评价主体的角度分析,上述教学实录片段采用的评价方式是学生互评和教师评价的方式。
学生互评是最有说服力的评价方式,可以起到互相督促、互相学习的作用,激励学生你追我赶,并培养学生虚心听取他人意见.诚恳对待学习伙伴的态度.以及良好的团队合作精神。
教师本身以教育者的身份及其教育方面的专业知识确立了其在学生中的权威性和影响力。教师的认可、赞扬可以使学生获得成就感,增强自信。且教师在学生学习过程中是最能仔细观察、了解学生的学习情况并及时予以引导的人. -
第5题:
(2008)质量相同的氢气(H2)和氧气(O2),处在相同的室温下,则它们的分子平均平动动能和内能的关系是:()
- A、分子平均平动动能相同,氢气的内能大于氧气的内能
- B、分子平均平动动能相同,氧气的内能大于氢气的内能
- C、内能相同,氢气的分子平均平动动能大于氧气的分子平均平动动能
- D、内能相同,氧气的分子平均平动动能大于氢气的分子平均平动动能
正确答案:A -
第6题:
下列说法不符合质量守恒定律的是()。
- A、镁条在空气中燃烧后,生成物的质量比镁条的质量增加了
- B、木炭燃烧后,留下的炭灰的质量比木炭的质量减少了
- C、2g氢气与8g氧气反应生成了10g水
- D、8g氢气与8g氧气反应生成了9g水
正确答案:C -
第7题:
稀硫酸能和金属活动顺序表中氢之前的所有金属反应,生成氢气。
正确答案:正确 -
第8题:
在实验室快速抽取较纯的氢气,最好用()
- A、纯锌跟稀硫酸
- B、纯锌跟浓硫酸
- C、锌跟稀盐酸
- D、粗锌跟稀硫酸
正确答案:D -
第9题:
填空题用锌跟稀硫酸反应制取氢气时,若有1120mL(标准状况下)的氢气生成,则有____mol电子发生转移.正确答案: 0.1mol解析:
反应生成1.12L的氢气,即0.05mol氢气生成,每1mol氢气产生会转移电子2mol,因此,该反应共转移电子数0.1mol. -
第10题:
单选题在实验室里,常用于制取氢气的反应是( ).A锌跟浓硫酸反应
B锌跟稀硫酸反应
C锌跟稀硝酸反应
D锌跟浓硝酸反应
正确答案: D解析:
ACD三项,较活泼的金属锌的单质跟氧化性酸——浓硫酸、稀硝酸、浓硝酸等反应时,产生的气体分别是SO2、NO、NO2,不能产生氢气;B项,实验室中使用锌与稀硫酸反应制取氢气. -
第11题:
单选题在实验室快速抽取较纯的氢气,最好用()A纯锌跟稀硫酸
B纯锌跟浓硫酸
C锌跟稀盐酸
D粗锌跟稀硫酸
正确答案: D解析: 快速制备氢气,最好用粗锌和稀硫酸。 -
第12题:
单选题实验室快速制取氢气,最好的方法应该用( ).A纯锌与稀硫酸
B粗锌(含锡等)与稀硫酸
C粗锌与稀硝酸
D粗锌与浓硫酸
正确答案: B解析:
AB两项,两者都能得到氢气,但B项反应速度比较快,因为锌—锡形成原电池,加快了氢气的生成速度.C项,锌与非氧化性酸溶液反应放出氢气,与氧化性酸反应不放出氢气,锌与稀硝酸反应不生成氢气;D项,浓硫酸与锌反应不生成氢气. -
第13题:
锌与盐酸(HCl)反应生成氢气和氯化锌。实验室里用6.5g锌与足量盐酸反应,可
制得氢气和氯化锌的质量各是多少?
解:设制得H2的质量为x,ZnCl2 的质量为y。 Zn+2HCl=ZnCl2+H2↑ 65 136 2 6.5 g y x x=6.5g×2/65=0.2g y=136×6.5g/65=13.6g 答:可制得H2的质量约为0.2 g,ZnCl2的质量约为13.6 g。 -
第14题:
下列金属与足够稀硫酸反应放出氢气,如果金属的质量都是5g,放出氢气最少的是( )。
A.Mg
B.Fe
C.Zn
D.Al
正确答案:C
-
第15题:
如图所示,天平左右两端的烧杯中有等量稀盐酸,并处于平衡状态。现在天平左右两端的烧杯中,分别加入相同质量的锌块与铜块,结果发现天平右侧缓慢下降,主要的原因是( )。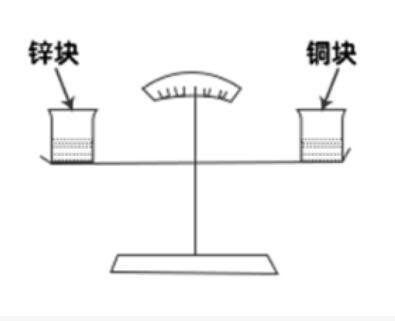 A.相同质量的铜块与锌块大小不同
A.相同质量的铜块与锌块大小不同
B.铜块与稀盐酸反应产生了氯化铜
C.锌块与稀盐酸反应产生了氢气
D.化学反应产生了大量水蒸气答案:C解析:第一步,确定题型。
本题考查化学反应。
第二步,根据天平的状态进行分析。
①初始:天平两端有等量稀盐酸,并处于平衡状态。
②过程:相同质量的锌块与铜块分别加入天平左右两端。
③结果:天平右侧(铜块)缓慢下降。
第三步,分析选项。
A项:天平是称质量的,整体的上升和下降只与物体的质量有关系,与体积没有关系,排除;
B项:铜块与稀盐酸不反应,排除;
C项:锌块和稀盐酸反应产生了氢气,质量变轻,符合;
D项:铜块不与稀盐酸发生反应,锌块和稀盐酸反应产生氢气,不是水蒸气,排除。
因此,选择C选项。 -
第16题:
为测定某铜锌合金中的铜的质量分数,某校化学兴趣小组用该合金与稀硫酸反应,进行了三次实验。所有的相关数据记录见下表(实验误差忽略不计);
(1)计算该合金中铜的质量分数;
(2)求第三次实验所得溶液中溶质的质量分数。答案:解析:
-
第17题:
金属镁、钠分别与足量的稀硫酸反应,若放出氢气的质量相等,则所需要金属镁与钠的质量比为24:23。
正确答案:错误 -
第18题:
将Mg、Al、Zn分别放入相同溶质质量分数的盐酸中,反应完全后,放出的氢气质量相同,其可能原因是()
- A、放入的三种金属质量相同,盐酸足量
- B、放入的Mg、Al、Zn的质量比为12:18:32.5,盐酸足量
- C、盐酸质量相同,放入足量的三种金属
- D、放入盐酸的质量比为3:2:1,反应后无盐酸剩余
正确答案:C -
第19题:
实验室测得乙烯和氧气混合气体密度是氢气的14.5倍,可知其中乙烯的质量分数为()
- A、25%
- B、27.6%
- C、72.4%
- D、75%
正确答案:C -
第20题:
质量相同的氢气(H2)和氧气(O2),处在相同的室温下,则它们的分子平均平动动能和内能关系为()。
- A、分子平均平动动能相同,氢气的内能大于氧气的内能
- B、分子平均平动动能相同,氧气的内能大于氢气的内能
- C、内能相同,氢气的分子平均平动动能大于氧气的分子平均平动动能
- D、内能相同,氧气的分子平均平动动能大于氢气的分子平均平动动能
正确答案:A -
第21题:
填空题某链烃A分子中碳和氢元素的质量比为6:1,A的蒸气对氢气的相对密度为21,它能跟溴水反应生成B、A和B的结构简式为____和____.正确答案: CH2=CHCH3,CH2BrCHBrCH3解析:
因为该链烃分子中碳和氢元素的质量比为6:1,因此可得其最简式为CH2,由“A的蒸汽对氢气的相对密度为21”可知其相对分子质量为42,故A的分子式为C3H6,由于A能跟溴水反应,所以它含有碳碳双键,A、B的结构简式为CH2=CHCH3与CH2BrCHBrCH3. -
第22题:
单选题实验室中欲快速制取氢气,最好的方法应该用( ).A纯锌和稀硫酸反应
B纯锌和浓硫酸反应
C粗锌(含铜、铅等杂质)与稀盐酸反应
D粗锌与硝酸反应
正确答案: C解析:
实验室制取氢气采用粗锌加稀盐酸,粗锌中的杂质与锌和稀盐酸溶液形成化学电池,加快了反应的进行. -
第23题:
单选题某金属跟盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,此金属是( ).AAl
BFe
CCu
DMg
正确答案: B解析:
AD两项,该金属与Zn组成原电池时,Zn为负极,所以该金属应位于Zn的后面;C项,因该金属与盐酸反应生成氢气,所以它应是金属活动性顺序中氢以前的金属;由此可知,该金属在金属活动性顺序中的位置是在氢前锌后,因此该金属为Fe.
