在一个密闭的容器中,加入一定量的NH4I(s),发生如下反应:,当反应达到平衡时,c(HI)=4mol/L,c(I2)=0.5mol/L,下列说法正确的是()。 A.平衡时,c(NH3)=6mol/L B.反应起始时固体NH4I是5mol C.平衡时HI的分解率为20% D.若改变反应起始固体NH4I的量,保持其他条件不变,平衡时各气体浓度也发生改变
题目
B.反应起始时固体NH4I是5mol
C.平衡时HI的分解率为20%
D.若改变反应起始固体NH4I的量,保持其他条件不变,平衡时各气体浓度也发生改变
相似考题
更多“在一个密闭的容器中,加入一定量的NH4I(s),发生如下反应:,当反应达到平衡时,c(HI)=4mol/L,c(I2)=0.5mol/L,下列说法正确的是()。 ”相关问题
-
第1题:
在恒容密闭容器中,将CO和H2S混合加热,发生下列反应并达到平衡:
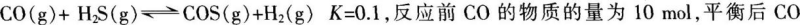
物质的量为8 mol。下列说法正确的是( )。《》()A.升高温度,H2S浓度增加,表明正反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7 mol
D.C0的平衡转化率为80%答案:C解析:升高温度,H2S的浓度增加,说明反应向逆反应方向进行,则逆反应是吸热反应,正反应是放热反应,A项错误。通入CO后,正反应速率先增大后逐渐减小至平衡,B项错误。反应平衡后消耗了2molCO,同

-
第2题:
在0.1 mol/L的CH3COOH溶液中存在如下电离平衡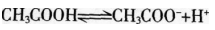 ,对该平衡下列叙述中,正确的是( )。
,对该平衡下列叙述中,正确的是( )。
A.加入水后,平衡向逆反应方向移动
B.加入0.1 mol/L的HCl溶液,溶液中c(H+)减小
C.加入少量NaOH固体,平衡向正反应方向移动
D.加入少量CH3COONa固体.平衡向正反应方向移动答案:C解析:加水稀释,平衡向右移动,A项错误;加入HCl溶液,引入了H+,平衡向左移动,但c(H+)增大,B项错误;加入少量NaOH固体,中和了部分H+,平衡向右移动,C项正确;加入CH3COONa,。(CH3COOH-)增大。平衡向左移动。D项错误。 -
第3题:
在2L密闭容器中发生下列反应:3A(g)+B(g)===2C(g),若最初加入A和B的物质的量都是4mol,A的平均反应速率是0.12mol/(L·s),则10s后容器中B的物质的量是()mol。
- A、3.2
- B、4.5
- C、5.2
- D、2.6
正确答案:A -
第4题:
在容器不变的密闭容器中,在一定条件下发生反应:2A(g)=B(g)+C(S),且达到化学平衡,当升高温度时其容器内气体的密度增大,则下列判断正确的是()
- A、若正反应是吸热反应,则A为非气态
- B、若正反应是放热反应,则A为气态
- C、若在平衡体系中加入少量C该平衡向逆反应方向移动
- D、压强对该平衡的移动无影响
正确答案:A,B -
第5题:
在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述中不正确的是()。
- A、容器内气体颜色不变
- B、容器内分子总数不变
- C、容器内压强不变
- D、容器内发生的反应属于取代反应
正确答案:D -
第6题:
在2升的密闭容器中进行反应:N2(气)+3H2(气)=2NH3(气),30s内有0.6mol氨生成,正确表示这30s内的反应速度的是()。
- A、VN2=0.005rnol/(L¡¤s)
- B、VH2=0.015rnol/(L¡¤s)
- C、VNH3=0.01rnol/(L¡¤s)
- D、VNH3=0.02rnol/(L¡¤s)
正确答案:A,B,C -
第7题:
25℃时反应N2(g) +3H2(g) =2NH3(g)的ΔrHθm=-92 KJ.mol-1,在密闭容器中该反应达到平衡时,若加入一定量的氖气会出现()
- A、平衡右移,氨产量增加
- B、平衡左移,氨产量减少
- C、平衡状态不变
- D、正反应速率加快
正确答案:C -
第8题:
H2(g)+I2(g)→2HI(g)的反应中,556K时的反应速率常数k1=4.45×10-5 mol-1.L.S-1,700K时k2=6.43×10-2 mol-1.L.S-1。 试求: (1)该反应为几级反应? (2)反应的活化能Ea
正确答案: (1)2
(2)Ea=163.5KJ/mol -
第9题:
在2L的密闭容器中进行反应:N2(气)+3H2(气)=2NH3(气),30s内有0.6mol氨生成,表示这30s内的反应速度不正确的是()。
- A、VN2=0.005mol/(L•s)
- B、VH2=0.015mol/(L•s)
- C、VNH3=0.01mol/(L•s)
- D、VNH3=0.02mol/(L•s)
正确答案:D -
第10题:
在通常温度下,NH4HCO3(s)可发生下列分解反应: NH4HCO3(s)=NH3(g)+CO2(g)+H2O(g)设在两个容积相等的密闭容器A和B中,分别加入纯NH4HCO3(s)1kg 及20kg,均保持在298K达到平衡后,下列哪种说法是正确的?()
- A、两容器中压力相等
- B、A内压力大于B内压力
- C、B内压力大于A内压力
- D、须经实际测定方能判别哪个容器中压力大
正确答案:A -
第11题:
填空题反应2CO(g)+O2(g)=2CO2(g)为放热反应,在一密闭容器内,当反应达到平衡时,若向体系内加入CO2(g),平衡()移动;若降低温度,平衡()移动;若加入催化剂,平衡()移动正确答案: 向左,向右,不解析: 暂无解析 -
第12题:
单选题25℃下,N2(g)+3H2(g)→2NH3(g)在密闭容器中反应达到化学平衡时,若加入惰性气体,估计会出现()。A平衡右移,氨产量增加
B平衡左移,氨产量减小
C平衡状态不变
D正反应速率加快
正确答案: A解析: 暂无解析 -
第13题:
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应: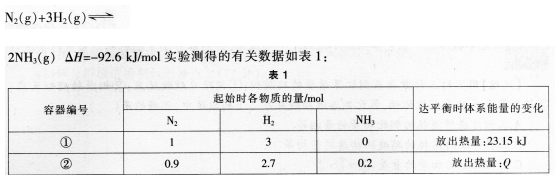
下列叙述中,正确的是()。
A.容器②中达平衡时放出的热量Q=23.15kJ
B.平衡时,①容器中N2的转化率为25%
C.容器①和②中反应的平衡常数不相等
D.若容器①体积为0.5L,则平衡时放出的热量大于23.15KJ答案:B解析:②中含有0.2 mol NH3相当于在①的基础上已经反应生成了0.2mol NH3,则平衡时放出
-
第14题:
一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
各容器中起始物质的量浓度与反应温度如表1所示,反应过程中甲、丙容器中 C02的物质的量随时间变化关系如图2所示: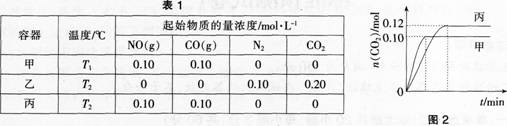
下列说法正确的是( )。
A.该反应的正反应为吸热反应
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol N0和0.10 molC02,此时v(正)<v(逆)答案:B解析: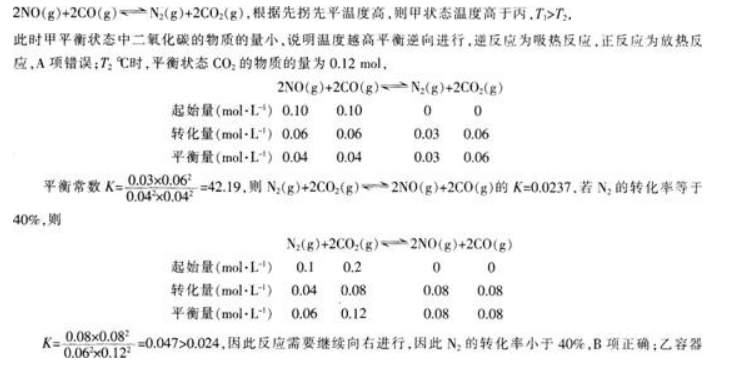
中的气体相当于甲中气体的2倍,建立平衡后,相当于甲平衡后增大压强,平衡向右移动.气体的物质的量减少,压强小于甲容器的2倍,C项错误;丙容器中反应达到平衡后,再充人0.10 mol NO和0.10 mol CO2.相当于增大压强,平衡正向移动,此时υ(正)大于υ(逆),D项错误;故本题选B。 -
第15题:
对于电池反应Cu2++Zn=Cu+Zn2+,下列说法正确的是()
- A、当(Cu2+)=c(Zn2+)时,反应达到平衡
- B、当(Cu2+/Cu)=(Zn2+/Zn)时,反应达到平衡
- C、当(Cu)=(Zn)时,反应达到平衡
- D、当原电池的标准电动势等于零时,反应达到平衡
正确答案:B -
第16题:
合成氨的反应式为N2+3H2§2NH3,在400℃时,反应达到平衡,各物质的平衡浓度为:[N2]=3mol/L,[H2]=9mol/L,[NH3]=4mol/L,求在该温度下的平衡常数Kc.KP以及N2和H2的原始浓度。
正确答案:N.sub>2+3H2§2NH3
原始浓度mol/L:O
平衡浓度mol/L:394
K.c=[NH3]27([N2][H2]3)=42/(3×93)=7.32xl0-3(mol/L)
砟=Kc(RT)ZV’
K.p=7.32×10-3×[0.082×(273+400)】‘2一(3+1’1—2.4xl0-6-J
N.sub>2的原始浓度为:3+4×1/2=5(mol/L)
H.sub>2的原始浓度为:9+4×372=15(mol/L)
答:在该温度下的平衡常数Kc=7.32×10-3,KP=2.4×10-6,N2的原始浓度为5mol/L,H2的原始浓度为15mol/L。 -
第17题:
当某密闭容器中建立了化学平衡S02+N02=SO3+NO后,若往容器中通入少量氧气时,将会发生的变化是()。
- A、化学平衡向正反应方向移动
- B、化学平衡向逆反应方向移动
- C、化学平衡不移动
- D、容器内反应速度加快(正、逆速度均加快)
正确答案:A,D -
第18题:
对于密闭容器中的反应,N2+3H2→2NH3+热,达到热平衡后,充入惰性气体,下列说法正确的是()。
- A、向正反应方向移动
- B、向逆反应方向移动
- C、不移动
- D、先向正反应方向移动,后向逆反应方向移动
正确答案:C -
第19题:
在1000℃ 时.下列反应:FeO(s)+ CO(g)=Fe(s)+CO2(g)的标准平衡常数Kθ= 0.5,如果在CO的分压力为6000kPa的密闭容器加入足量的FeO,计算CO和CO2的平衡分压。
正确答案: P.CO)=4000kPa,
P.CO2)=2000kPa -
第20题:
在产生烟雾的反应中臭氧O3是一个很重要的物质。在一次臭氧分析中,将在标准状况下的空气2.0×105L吹入NaI溶液中,其中的O3在通过NaI溶液时发生了下列反应:H2O+O3+2I-=O2+I2+2OH-; 反应中生成的I2用0.01000molL-1Na2S2O3溶液滴定,反应是:I2+2Na2S2O3=2I-+4Na++S4O62-; 在这次分析中用去了0.42mL的Na2S2O3溶液。 ⑴计算与Na2S2O3溶液发生作用的I2的物质的量(); ⑵在前一反应中生成了()摩尔的I2; ⑶在2.0×105L空气中含有()摩尔的O3; ⑷在标准状况下这些O3占有()体积; ⑸在该空气样品中O3的浓度(用μL/L表示)有() 。
正确答案:2.1×10-6mol;2.1×10-6mol;2.1×10-6mol;4.707×10-5L;2.35×10-4μL/L -
第21题:
在2升的密闭容器内进行反应:N2+3H2=2NH3,30s内有0.6nol氨气生成,正确表示这30秒内的反应速度的是()。
- A、VN2=0.005mol/(L·s)
- B、VH2=0.015rnol/(L¡¤s)
- C、VNH3=0.01mol/(L·s)
- D、VNH3=0.02rnol/(L¡¤s)
正确答案:A,B,C -
第22题:
在刚性密闭容器中,有下列理想气体的反应达到平衡 A(g) + B(g) =C(g) 若在恒温下加入一定量的惰性气体,则平衡将:()
- A、向右移动
- B、向左移动
- C、不移动
- D、无法确定
正确答案:C -
第23题:
单选题在密闭容器中,反应mA(g)+nB(s)pC(g)达到平衡后,把密闭容器体积减小,则A的转化率降低.下列关系式中正确的是( ).Am+n>p
Bm+n<p
Cm<p
Dm=p
正确答案: D解析:
密闭容器体积减小,就是增大压强(因反应中有气态物质参与),A的转化率降低,就是平衡向左移动;再根据平衡移动原理可知,加压平衡向气体体积减小的方向移动.所以,得到m<p
