由标准锌电极和标准铜电极组成原电池: (-)Zn︱ZnSO4(1 mol.L-1)‖CuSO4(1 mol.L-1) ︱Cu(),改变下列条件对原电池电动势有何影响?(1)增加ZnSO4溶液的浓度; (2) 在ZnSO4溶液中加入过量的NaOH; (3)增加铜片的电极表面; (4)在CuSO4溶液中加入H2S。
题目
由标准锌电极和标准铜电极组成原电池: (-)Zn︱ZnSO4(1 mol.L-1)‖CuSO4(1 mol.L-1) ︱Cu(),改变下列条件对原电池电动势有何影响?(1)增加ZnSO4溶液的浓度; (2) 在ZnSO4溶液中加入过量的NaOH; (3)增加铜片的电极表面; (4)在CuSO4溶液中加入H2S。
相似考题
更多“由标准锌电极和标准铜电极组成原电池: (-)Zn︱ZnSO4(1 mol.L-1)‖CuSO4(1 mol.L-1) ︱Cu(),改变下列条件对原电池电动势有何影响?(1)增加ZnSO4溶液的浓度; (2) 在ZnSO4溶液中加入过量的NaOH; (3)增加铜片的电极表面; (4)在CuSO4溶液中加入H2S。”相关问题
-
第1题:
将铜片插入盛有0.5mol•L-1的CuSO4溶液的烧杯中,银片插入盛有0.5mol•L-1的AgNO3溶液的烧杯中。 (1)写出该原电池的符号; (2)写出电极反应式和原电池的电池反应; (3)求该电池的电动势; (4)若加氨水于CuSO4溶液中,电池电动势如何变化?若加氨水于AgNO3溶液中,电池电动势又如何变化?(定性回答)参考答案:
-
第2题:
在铜锌原电池中,往CuSO4溶液中加入氨水,电池电动势将有何变化?A.变大
B.不变
C.变小
D.无法确定答案:C解析:提示:在铜锌原电池中铜电极为正极;在CuSO4溶液中加入氨水形成铜氨配离子,使溶液中Cu2+离子浓度降低。电动势=φ正-φ负。 -
第3题:
纳氏试剂比色法测定氨氮时,如水样浑浊,可于水样中加入适量()。
- A、ZnSO4和HCl
- B、ZnSO4和NaOH溶液
- C、SnCl2和NaOH溶液
正确答案:B -
第4题:
可用“CSE”表示的参比电极是()。
- A、Cu/CuSO4饱和溶液
- B、Ag/AgCl饱和溶液
- C、锌电极
- D、饱和甘汞电极
正确答案:A -
第5题:
把铜片浸入Cu2+浓度为1mol/l的溶液中,和标准氢电极组成原电池,实验测得E电池=0.337伏,则φθCu2+/Cu等于()。
- A、-0.337伏
- B、0
- C、0.337伏
- D、无法计算
正确答案:C -
第6题:
有下列原电池: (-)Cd∣CdSO4(1mol˙L-1)∣∣CuSO4(1mol˙L-1)∣Cu(+) 若往CdSO4溶液中加入少量Na2S溶液,或往CuSO4溶液中加入少量CuSO4˙5H2O晶体,都会使原电池的电动势变小。
正确答案:错误 -
第7题:
将铜片插入盛有0.5mol/L的CuSO4溶液的烧杯中,银片插入盛有0.5mol/L的AgNO3,溶液的烧杯中,已知:φθ(Ag+/Ag)=0.7996V, φθ(Cu2+/Cu)=0.337V写出电极反应式和原电池的电池反应
正确答案:电极反应式: (-) Cu2++ 2e-←→ Cu (+) Ag++ e-←→ Ag
电池反应式: Cu+2Ag+←→ 2Ag+Cu2+ -
第8题:
在标准Cu电极和标准Zn电极组成的原电池中,如想使电动势增加,则采取()
- A、增大Zn2浓度
- B、减小Cu2浓度
- C、向Cu2溶液中加氨水
- D、向Zn2溶液中加氨水
正确答案:D -
第9题:
除去ZnSO4溶液中所含的少量CuSO4,最好选用下列物种中的()
- A、NH3·H2O
- B、NaOH
- C、Zn
- D、H2S
正确答案:C -
第10题:
原电池的写法,习惯上把()极写在左边,()极写在右边,故下列电池中Zn︳ZnSO4︳CuSO4︳Cu()极为正极,()极为负极。
正确答案:负,正,Cu,Zn -
第11题:
单选题除去ZnSO4溶液所含少量CuSO4最好选用下列试剂中的( )。ANH3水
BNaOH
CZn粉
DH2S
正确答案: B解析:
向溶液中加锌粉,发生置换反应如下:
Zn+CuSO4→ZnSO4+Cu -
第12题:
单选题在铜锌原电池中,往CuSO4溶液中加入氨水,电池电动势将有何变化?()A变大
B不变
C变小
D无法确定
正确答案: A解析: 暂无解析 -
第13题:
将金属锌插入硫酸锌溶液和将金属铜插入到硫酸铜溶液所组成的电池应记为()。A.ZnZnSO4CuSO4
B.Zn|ZnSO4Cu|CuSO4
C.Zn|ZnSO4CuSO4|Cu
D.Zn|ZnSO4‖CuSO4|Cu
参考答案:D
-
第14题:
已知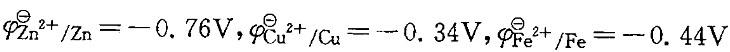 ,当在ZnSO4 (1. 0mol/L)和CuSO4(1.0mol/L)的混合溶液中放入一枚铁钉得到的产物是:
,当在ZnSO4 (1. 0mol/L)和CuSO4(1.0mol/L)的混合溶液中放入一枚铁钉得到的产物是:
A.Zn、Fe2+和Cu B.Fe2+和Cu
C. Zn、Fe2+和H2 D.Zn和Fe2+答案:B解析:提示:加入铁钉是还原态,它能和电极电势比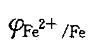 高的电对中的氧化态反应。
高的电对中的氧化态反应。 -
第15题:
为探究Zn和Cu的金属活动性强弱,提供的试剂有:Zn、Cu、H2SO4溶液、ZnSO4溶液、CuSO4溶液。下列说法正确的是()
- A、选用两种试剂可实现实验目的
- B、ZnSO4溶液中加人Cu不能探究金属活动性强弱
- C、最多只能设计一种实验方案
- D、根据Zn和Cu的硬度能判断金属活动性强弱
正确答案:A -
第16题:
ZnSO4溶液中加入Na2CO3溶液产物是()
- A、ZnCO3
- B、ZnCO3·Zn(OH)2
- C、ZnO
- D、Zn(OH)2
正确答案:B -
第17题:
原电池必须由两个半电池组成,所以将两块锌片分别插入两种不同浓度的ZnSO4溶液中不能组成原电池。()
正确答案:正确 -
第18题:
在铜锌原电池的铜电极一端的电解质溶液中加入氨水后,其电动势将()。
- A、减小
- B、增大
- C、不变
- D、无法判断
正确答案:A -
第19题:
向原电池(-)Zn|Zn2+(1mol·L-1)||Cu2+(1mol·L-1)|Cu(+)的正极溶液中通入H2S气体,则原电池的电动势()
- A、增加
- B、减小
- C、不变
- D、无法判断
正确答案:B -
第20题:
在铜锌原电池中,往CuSO4溶液中加入氨水,电池电动势将有何变化?()
- A、变大
- B、不变
- C、变小
- D、无法确定
正确答案:C -
第21题:
对原电池(-)Zn|Zn2+(c1)‖Ag(c2)|Ag(+)而言,欲使其电动势增加可采取的措施有()。
- A、增大Zn2+的浓度
- B、增加Ag+的浓度
- C、加大锌电极面积
- D、增加Ag电极的面积
正确答案:B -
第22题:
以铜作电极电解CuSO4水溶液, 阳极区中CuSO4的浓度将();浓度为m的MgCl2溶液的离子强度I =()。
正确答案:增加;3m -
第23题:
单选题对原电池(-)Zn|Zn2+(c1)‖Ag(c2)|Ag(+)而言,欲使其电动势增加可采取的措施有()。A增大Zn2+的浓度
B增加Ag+的浓度
C加大锌电极面积
D增加Ag电极的面积
正确答案: C解析: 暂无解析 -
第24题:
单选题假设规定标准氢电极的电极电势φθ(H+/H2)=1V,则测得下列原电池:(-)Zn|Zn2+(1mol·dm-3)||H+(1mol·dm-3)|H2(pθ)(Pt)(+)的标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)的数值变化为()A标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)各增加1V
B标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)各减少1V
C标准电动势Eθ不变,锌标准电极电势φθ(Zn2+/Zn)增加1V
D标准电动势Eθ不变,锌标准电极电势φθ(Zn2+/Zn)减少1V
E标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)均不变
正确答案: E解析: 暂无解析
