因为jϴ (MnO2/Mn2+) < jϴ(Cl2/Cl-),所以绝不能用 MnO2与盐酸作用制取 Cl2。
题目
因为jϴ (MnO2/Mn2+) < jϴ(Cl2/Cl-),所以绝不能用 MnO2与盐酸作用制取 Cl2。
相似考题
参考答案和解析
更多“因为jϴ (MnO2/Mn2+) < jϴ(Cl2/Cl-),所以绝不能用 MnO2与盐酸作用制取 Cl2。”相关问题
-
第1题:
将反应MnO2 + HCl→MnCl2 +Cl2 + H2O配平后,方程中MnCl2 的系数是:
A. 1 B.2 C. 3 D.4答案:A解析:提示:可以用氧化还原配平法。配平后的方程式为MnO2+4HCl=MnCl2 +Cl2 + H2O。 -
第2题:
下列实验方案正确、能达到相应实验预期目的且安全的是( )。A.制取少量蒸馏水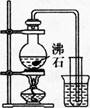
B.用铜和浓硝酸制取少量N02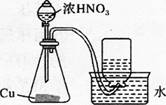
C.比较MnO2、Cl2、I2的氧化性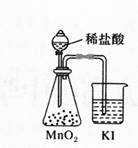
D.探究NaHC03的热稳定性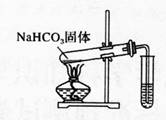 答案:A解析:对天然水加热,使水变成水蒸气进入到盛冷水的烧杯中,水蒸气遇冷变成小水滴,即蒸馏水,沸石可防止爆沸,A项正确;二氧化氮可以和水反应,不能用排水法来收集,B项错误;二氧化锰和稀盐酸不反应。所以不能获得氯气,二氧化锰要和浓盐酸在加热条件下才能发生反应,C项错误;对固体物质加热时,试管口向下倾斜,防止水倒流,炸裂试管,D项错误。
答案:A解析:对天然水加热,使水变成水蒸气进入到盛冷水的烧杯中,水蒸气遇冷变成小水滴,即蒸馏水,沸石可防止爆沸,A项正确;二氧化氮可以和水反应,不能用排水法来收集,B项错误;二氧化锰和稀盐酸不反应。所以不能获得氯气,二氧化锰要和浓盐酸在加热条件下才能发生反应,C项错误;对固体物质加热时,试管口向下倾斜,防止水倒流,炸裂试管,D项错误。 -
第3题:
用间接滴定法测定软锰矿中MnO2时,先加入过量HCl,将生成的过量Cl2通入KI溶液中,最后用Na2S2O3滴定生成的I2,则MnO2与Na2S2O3的计量关系是()。
- A、1:2
- B、1:4
- C、1:1
- D、2:1
正确答案:A -
第4题:
Eθ(Cr2O72-/Cr3+)〈Eθ(Cl2/Cl-),但是,K2Cr2O7与浓度较大的HCl(aq)可以反应生成Cl2。这是由于c(HCl)增大,使E(Cr2O72-/Cr3+)增大,同时又使E(Cl2/Cl-)减小,从而使E(Cr2O72-/Cr3+)〉(Cl2/Cl-)。
正确答案:正确 -
第5题:
Eθ(Cl2/Cl-)〈Eθ(Cl2/AgCl)。
正确答案:正确 -
第6题:
根据电极电势比较KMnO4﹑K2Cr2O7和MnO2与盐酸(1mol.L-1)反应而生成Cl2的反应趋势。
正确答案: 根据电极电势的关系,可知反应趋势:
KMnO4〉K2Cr2O7〉MnO2。 -
第7题:
电池Ag|Ag+(aq)||Cl-(aq)|Cl2(g),Pt与Ag(s),AgCl-(s)|Cl-(aq)|Cl2(g),Pt对应一个电池反应.
正确答案:错误 -
第8题:
已知在酸性介质中,φΘMnO2/Mn2+=1.23V,在[Mn2+]=1.0mol.L-1,PH=6时,φ(MnO2/Mn2+)等于()V.
- A、1.23
- B、0.71
- C、0.52
- D、1.94
正确答案:C -
第9题:
根据标准电极电位,氧化还原反应MnO2+2Cl-+4H+==Mn2++Cl2+2H2O中,MnO2不能氧化Cl-,但用浓盐酸与MnO2作用,可以生成Cl2。下列哪一种解释最不合理:()
- A、两个电对的标准电极电位相差不大;
- B、酸度增加,E°(MnO2/Mn2+)增加;
- C、[Cl-]增加,E°(Cl2/Cl-)减小;
- D、盐酸浓度增加,氧化还原反应的速率加大。
正确答案:D -
第10题:
实验室中用MnO2和任何浓度HCl作用,都可以制取氯气
正确答案:错误 -
第11题:
电池Ag | Ag+(aq)||Cl-(aq)|Cl2(g),Pt与Ag(s),AgCl(s)|-(aq)|Cl2(g),Pt对应一个电池反应.
正确答案:错误 -
第12题:
单选题已知,从标准电极电势看,MnO2不能氧化Cl-,但用MnO2加浓盐酸,可以生成Cl2,这是因为()。A两个相差不大
B酸性增强,也增加
CCl-浓度增加,减少
D以上三个因素都有
正确答案: B解析: 暂无解析 -
第13题:
已知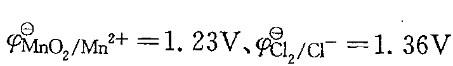 ,从φΘ看MnO2不能氧化Cl- ,但将浓盐酸加入MnO2时,可生成Cl2。对其原因下列中啷项说明是正确的?
,从φΘ看MnO2不能氧化Cl- ,但将浓盐酸加入MnO2时,可生成Cl2。对其原因下列中啷项说明是正确的?
A. Cl-浓度增加,使φCl2/Cl减少,H+浓度增加,使φMnO2/Mn2+增加
B.两个φΘ相差不大
C.酸性增加,使φMnO2/Mn2+减小
D.以上三个因素都有答案:A解析:提示:MnO2与浓盐酸反应生成Cl2的反应式为
MnO2+4HCl=MnCl2+Cl2+2H2O
其中包括两个半反应
(1) MnO2+4H++2e-=Mn2++2H2O
该式的能斯特方程为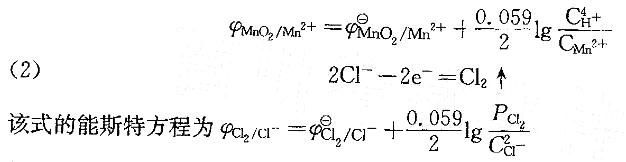
然后根据各自的能斯特方程,分析不同离子的浓度改变时对电极电势的影响。 -
第14题:
将反应MnO2 + HCl→MnCl2 +Cl2 + H2O配平后,方程中MnCl2 的系数是:A. 1
B.2
C. 3
D.4答案:A解析:提示 可以用氧化还原配平法。配平后的方程式为MnO2+4HCl=MnCl2 +Cl2 + H2O。 -
第15题:
Cl2分子的振动温度Θv=814K,则298.15K下分子的振动对Cl2的恒容摩尔热容的贡献为Cv,m=()J·K-1mol-1。
正确答案:4.63 -
第16题:
在实验室中MnO2(s)仅与浓HCl加热才能反应制取氯气,这是因为浓HCl仅使E(MnO2/Mn2+)增大。
正确答案:错误 -
第17题:
实验室中常用浓HCl与下列哪一些氧化剂反应,均可制取Cl2?()
- A、MnO2、KMnO4和CuO
- B、K2Cr2O和CuO
- C、MnO2和CuO
- D、MnO2、K2Cr2O和KMnO4
正确答案:D -
第18题:
因为φθCr2O72-/Cr3+=1.33V,φθCl2/Cl-=1.36V。所以用K2Cr2O7法滴定Fe2+,用盐酸溶液对测定()。
- A、不干扰
- B、干扰
- C、无关系
正确答案:A -
第19题:
在()性介质中,Cl2可把Mn(Ⅵ)氧化成Mn(Ⅶ)在()性介质中,Mn(Ⅶ)可把Cl-氧化成Cl2
正确答案:碱;酸 -
第20题:
在酸性介质中,已知φθMnO2/Mn2+=1.09v,当C(Mn2+)=1.0mol/L,PH=5时,φMnO2/Mn2+ =()v。
- A、0.50
- B、1.09
- C、1.68
- D、0.71
正确答案:A -
第21题:
已知,从标准电极电势看,MnO2不能氧化Cl-,但用MnO2加浓盐酸,可以生成Cl2,这是因为()。
- A、两个相差不大
- B、酸性增强,也增加
- C、Cl-浓度增加,减少
- D、以上三个因素都有
正确答案:D -
第22题:
实验室制备气体Cl2的最常用的方法是()
- A、KMnO4与浓盐酸共热;
- B、MnO2与浓盐酸共热;
- C、KMnO4与稀盐酸反应;
- D、MnO2与稀盐酸反应。
正确答案:B -
第23题:
填空题实验室用浓盐酸跟MnO2反应制取氯气时,MnO2是____剂;用KClO3制取氧气时,MnO2是____剂.正确答案: 氧化剂,催化剂解析:
浓盐酸与MnO2反应制取氯气的反应中,氯离子失电子,作为还原剂,二氧化锰得电子作为氧化剂;在加热KClO3制取氧气的反应中,二氧化锰本身不参与反应,因此属于催化剂. -
第24题:
单选题制取CH3CH2Cl最好采用的方法是( ).A乙烷和Cl2光照取代
B乙烯和Cl2加成
C乙烯与HCl加成
D乙烯和H2加成后再与Cl2反应
正确答案: A解析:
A项,光照取代反应的产物有很多,无法得到纯净的CH3CH2Cl;B项,乙烯与氯气加成得不到CH3CH2Cl;C项,乙烯与HCl加成恰好得到CH3CH2Cl;D项,乙烯与氢气加成后生成乙烷,与氯气反应产物依然不单一.
