氯气常用于自来水消毒是因为次氯酸是强氧化剂,可以杀菌。此题为判断题(对,错)。
题目
氯气常用于自来水消毒是因为次氯酸是强氧化剂,可以杀菌。
此题为判断题(对,错)。
相似考题
更多“氯气常用于自来水消毒是因为次氯酸是强氧化剂,可以杀菌。 ”相关问题
-
第1题:
传统饮水的消毒剂是氯气。20世纪80年代初期科研人员在英国某城调查发现,儿童患白血病发病率高是源于饮了氯气消毒的饮用水,这是因为( )。
A.氯气有氧化性,作用于正常细胞而癌化
B.氯水中的次氯酸具有杀菌性,氧化了正常细胞,异化为癌细胞
C.氯气有毒,杀死正常细胞,不杀灭癌细胞
D.氯气作用于水中有机物,生成有机氯化合物而致癌
正确答案:D
D【解析】由于氯气相对比其他消毒剂经济便宜,成本低廉,容易获得,管理省事,现代许多大型自来水水厂依然沿用液氯进行消毒。但是,欧美发达国家研究发现,水中有机物等杂质清除率不高的话,很容易生成二氯甲烷、三氯甲烷、四氯化碳、甚至二恶因等致癌物质。氯气消毒饮用水可引发食道癌、胃癌、直肠癌、前列腺癌等癌症高发。
-
第2题:
自来水厂用来进行水消毒处理的常用化学试剂是:A. 臭氧
B. 氯气
C. 过氧化氢
D. 碘伏答案:B解析:考点生活常识
自来水生产中通常使用少量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。
用臭氧来净化自来水成本较高,使用较少。 -
第3题:
下列医院污水消毒方法中不妥的是( )。A.液氯消毒
B.漂白粉消毒
C.现场制备的次氯酸钠消毒
D.氯气直接消毒答案:D解析:严禁直接向污水中投加氯气。 -
第4题:
氯气加入水中之后,其杀菌作用主要是靠次氯酸。
此题为判断题(对,错)。
正确答案:√
-
第5题:
阅读下列材料,按要求完成教学设计任务。
材料一《普通高中化学课程标准(实验)》内容标准为:“通过实验了解氯、氮、硫、硅等非金属及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响”。活动与探究建议:“实验氯气的漂白性”。
材料二某高中化学教科书《化学1》“氯气与水的反应”的教学片段。
目前,很多自来水厂用氯气来杀菌、消毒,我们偶尔闻到的自来水散发出的刺激性气味就是余氯的气味。
氯气溶于水为什么能杀菌消毒呢在25 0C时.1体积的水可溶解约2体积的氯气.氯气的水溶液称为氨水。在常温下,溶于水中的部分Cl2与水发生如下反应: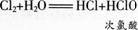
次氯酸(HClO)具有强氧化性,因此,次氯酸能杀死水中的病菌,起到消毒的作用。氯水也因为含有次氯酸而具有漂白作用。
次氯酸是很弱的酸,不稳定,只存在于水溶液中,在光照下易分解放出氧气:
近年来有科学家提出,使用氯气对自来水消毒时,氯气会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此,人们已开始研究并试用新的自来水消毒剂。如二氧化氯(C102)、臭氧等。

最初,人们直接用氯气作漂白剂,但因氯气的溶解度不大,而且生成的HCl0不稳定,难以保存,使用起来很不方便,效果也不理想,在C12与水反应原理的基础上,经过多年的实验、改进,才有了今天常用的漂白液和漂白粉。
材料三教学对象为高中一年级学生,他们已经学过了实验的基本方法,物质的量,氧化还原反应.金属及其化合物的相关知识。
要求:
结合上述材料,完成“氯气与水的反应”片段的教学设计,包括教学目标,教学重、难点,教学过程,板书设计(不少于300字)。答案:解析:(1)教学目标 【知识与技能目标】了解氯气与水反应的实质及产物;知道氯水的成分;认识次氯酸的性质和应用。
【过程与方法目标】通过观察、比较化学现象和反应,学会善于从实验中发现问题、分析问题、解决问题的方法。
【情感态度与价值观目标】通过实验激发学习化学的兴趣,树立将化学知识应用于生活、生产的意识。
(2)教学重、难点
【重点】氯气和水的反应、氯水的漂白性。
【难点】氯水的成分和漂白性。
(3)教学过程
环节一:导入新课
创设情景:有时候我们打开水龙头会闻到一股刺激性的气味,这种刺激性的气味来源于氯气,目前有很多自来水都采用氯气来杀菌、消毒,你知道这是为什么吗
导入:今天我们就来探索氯气和水的作用。
环节二:探究新知
对比启迪:我们知道二氧化碳能溶于水,与水反应生成碳酸,氯气能不能溶于水实验表明l体积的水大约溶解2体积的氯气.氯气的水溶液称之为氯水。氯气可以和水反应吗请同学们提出假设或猜想。
提问:如何证明氯气和水发生了反应请大家进行讨论。
【实验探究1】方案l:检验溶液的酸碱性,用玻璃棒蘸取少量的氯水点到紫色石蕊试纸上;方案2:检验氯离子,用胶头滴管吸取少量硝酸银置于小试管中,再用胶头滴管吸取少量氯水滴加到硝酸银溶液里。
请学生进行实验探究1并观察实验现象、得出结论。
设疑:在实验探究l中观察到湿润的蓝色石蕊试纸周围是红色的,它的中间部分是白色的,这意味着氯水中含有漂白性的物质。那氯水中具有漂白性的物质是什么首先我们要知道氯水中都存在哪些离子和分子。请大家根据已有知识进行讨论、推测。
这里我们考虑HCIO(次氯酸)和Cl---2到底是谁具有漂白性呢请学生思考讨论实验方案。
请学生进行实验探究并观察实验现象、得出结论。
【实验探究2】将氯气分别通入盛有干燥的红布条和湿润的红布条的广l:3瓶中,盖上玻璃片。
归纳:干燥的氯气无漂白性.潮湿的氯气有漂白性,所以可得具有漂白性的物质是HClO。
环节三:巩固练习
1.以下物质中,含有氯分子的是()。
A.液氯
B.氯水
C.盐酸
D.食盐
2.能使干燥有色布条褪色的物质是()。
A.氯气
B.氯化氢
C.氯水
D.液氯
环节四:小结作业
小结:这节课我们学习了哪些知识,请同学说一说。学生总结:氯气与水的反应原理,次氯酸的化学性质及应用。
作业:思考如何证明次氯酸的酸性比碳酸弱调研生活生产中还有哪些物质可以作为漂白剂,它们有什么区别
四、板书设计
