浓度为0.10mol·L-1的NaHCO3溶液的c(H+)近似等于(Ka1θ和Ka2θ 分别代表H2CO3的一级和二级电离常数)()A.B.C.D.
题目
A.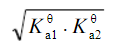
B.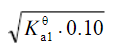
C.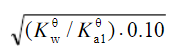
D.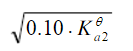
相似考题
更多“浓度为0.10mol·L-1的NaHCO3溶液的c(H+)近似等于(Ka1θ和Ka2θ 分别代表H2CO3的一级和二级电离常数)() A.B.C.D.”相关问题
-
第1题:
在H2S的Ka1、Ka2 表示式中的[H+]是()。
- A、Ka1中的大
- B、Ka2中的大
- C、Ka1、Ka2中的一样大
- D、不能确定
正确答案:C -
第2题:
将0.10mol·L-1的NaHCO3溶液加水稀释一倍,溶液的pH值基本不变。
正确答案:错误 -
第3题:
HAc-NaAc缓冲溶液的计算公式为()。
- A、[H+]=KaC酸/C盐
- B、[H+]=C·Ka
- C、[H+]=Ka1·Ka2
正确答案:A -
第4题:
H2C2O4的Ka1=5.9×10-2,Ka2=6.4×10-5,则其0.10mol/L溶液的pH为()。
- A、2.71
- B、1.11
- C、12.89
- D、11.29
正确答案:B -
第5题:
反应A→B+D,当A浓度分别等于0.10mol·L-1及0.050 mol·L-1时,反应速率比值v2/v1为0.50,则该反应的级数是:()
正确答案:1 -
第6题:
在0.10mol·L-1[Ag(NH3)2]+溶液中,含有1.0mol·L-1游离氨,溶液中Ag+的浓度为()。
正确答案:8.9×10-9mol·L-1 -
第7题:
已知0.10mol·L-1HA溶液的c(H+)=0.0013mol·L-1,则离解平衡常数为()。
正确答案:K=1.7×10-5 -
第8题:
0.10mol/LNaHCO3水溶液的pH为()。(列出表达式 并计算出结果,H2CO3的Ka1=4.3×10-7,Ka2=4.3×10-11)
正确答案:pH=1/2(pKa1+pKa2)=1/2(-lg4.3×10-7-lg4.3×10-11)=8.36 -
第9题:
室温下H2CO3饱和溶液的浓度c为0.040mol/L,求该溶液pH值(Ka1=4.2×10-7,Ka2=5.6×10-11)
正确答案: 可应用近似公式求解
=0.41×10-4)(mol/L)
pH=-lg[H+]=3.88 -
第10题:
单选题用c(NaOH)=0.1000mol/L的NaOH标准滴定溶液滴定c(NaOH)=0.1000mol/L的某二元弱酸溶液时,下列说法正确的是()。已知弱酸的两级离解常数分别为:Ka1=5.0×10-5,Ka2=1.5×10-10。A有一个滴定突跃,可滴定第一、二级电离的H+总和,但第一、二级电离不可分步滴定
B有两个滴定突跃,第一、二级电离可分步滴定
C没有明显的滴定突跃
D有一个滴定突跃,第一级电离的H+可被滴定,第二级电离的H+不能被滴定
正确答案: A解析: 暂无解析 -
第11题:
判断题将0.10mol·L-1的NaHCO3溶液加水稀释一倍,溶液的pH值基本不变。A对
B错
正确答案: 对解析: 暂无解析 -
第12题:
问答题室温下H2CO3饱和溶液的浓度c为0.040mol/L,求该溶液pH值(Ka1=4.2×10-7,Ka2=5.6×10-11)正确答案: 可应用近似公式求解
=0.41×10-4)(mol/L)
pH=-lg[H+]=3.88解析: 暂无解析 -
第13题:
0.10mol/LNa2CO3溶液的pH值为(Ka1=4.2×10-7、Ka2=5.6×10-11)()。
- A、10.63
- B、5.63
- C、11.63
- D、12.63
正确答案:B -
第14题:
已知三元弱酸的三级电离常数分别为:Ka1=1×10-3,Ka2=1×10-5,Ka3=1×10-6。 将此酸配成溶液后,用NaOH标准滴定溶液滴定时,应有()个pH突跃,宜选用()为指示剂。
正确答案:1;酚酞 -
第15题:
0.100mol·L-1H2SO4溶液的H+浓度是()。(Ka1>1,Ka2=1.2×10-2)
正确答案:0.110mol/L -
第16题:
0.10mol/LNa2S溶液的pH为()。(H2S的Ka1,Ka2分别为1.3×10-7,7.1×10-15)
- A、4.5
- B、2.03
- C、9.5
- D、13.58
正确答案:D -
第17题:
下列*叙述中不正确的是()
- A、对于弱酸溶液,浓度越小,电离度越大,氢离子浓度越大
- B、在多元弱酸的稀溶液中,其酸根的浓度近似等于其最后一级的离解平衡常数
- C、对于弱碱溶液,当加水稀释时,pH值减小
- D、对于弱电解质溶液,同离子效应使其电离度减小,盐效应使其电离度增加
正确答案:A -
第18题:
凡是多元弱酸,其酸根的浓度近似等于其最后一级电离常数。
正确答案:错误 -
第19题:
0.04mol/L H2CO3溶液中,C(H+)=() ;C(CO2-)= ()。已知Ka1=4.3×10-7 ,Ka2=5.6×10-11
正确答案:√1√10-4mol/L;K2=5.6×10-11mol/L -
第20题:
在H2S的饱和溶液中,下列结论中错误的是()。
- A、溶液中H+浓度主要取决于第一级电离
- B、溶液中S2-浓度最小,基本等于其第二级电离常数
- C、溶液中
- D、溶液中[H+]=2[S2-]
正确答案:D -
第21题:
已知KspΘ(ZnS)=2.5×10-22。在某溶液中Zn2+的浓度为0.10mol·L-1,通入H2S气体,达到饱和(c(H2S)=0.10mol·L-1),则ZnS开始析出时,溶液的[H+]为()
- A、0.51
- B、0.15
- C、0.21
- D、0.45
正确答案:C -
第22题:
单选题用c(NaOH)=0.1000mol/L的NaOH标准滴定溶液滴定c(NaOH)=0.1000mol/L的H2C2O4溶液时,下列说法正确的是()。已知H2C2O4的两级离解常数分别为:Ka1=5.9×10-2,Ka2=6.4×10-5。A有一个滴定突跃,可滴定第一、二级电离的H+总和,但第一、二级电离不可分步滴定
B有两个滴定突跃,第一、二级电离可分步滴定
C没有明显的滴定突跃
D有一个滴定突跃,第一级电离的H+可被滴定,第二级电离的H+不能被滴定
正确答案: B解析: 暂无解析 -
第23题:
单选题0.10mol/LNa2CO3溶液的pH值为(Ka1=4.2×10-7、Ka2=5.6×10-11)()。A10.63
B5.63
C11.63
D12.63
正确答案: A解析: 暂无解析
