将0.65g锌全部溶于200 mL稀盐酸中,然后加入80 mL 0.5 mol/L AgNO3溶液,恰好使Cl-沉淀完全。试计算: (1)产生多少升(标准状况下)氢气。 (2)原稀盐酸的物质的量浓度为多少。
题目
(1)产生多少升(标准状况下)氢气。
(2)原稀盐酸的物质的量浓度为多少。
相似考题
更多“将0.65g锌全部溶于200 mL稀盐酸中,然后加入80 mL 0.5 mol/L AgNO3溶液,恰好使Cl-沉淀完全。试计算: ”相关问题
-
第1题:
将6 mL 0.2 mol/L盐酸与10 mL 0.1 mol/L氨水混合,完全反应后,溶液中各种离子浓度的相对大小是.答案:解析: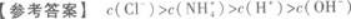 【解题指要】(1)首先要强调,将两种溶液混合时必须考虑这一过程中是否发生化学反应.如本题是将盐酸与氨水混合,会发生化学反应:
【解题指要】(1)首先要强调,将两种溶液混合时必须考虑这一过程中是否发生化学反应.如本题是将盐酸与氨水混合,会发生化学反应:

根据HCl和NH3的数量的不同.可能有三种情况:
①恰好完全反应,此时就变成NH4Cl溶液;
②HCl有剩余,此时就是NH4Cl和HCl的混合溶液;
③NH3有剩余,此时就是NH4Cl与NH3的混合溶液.
(2)盐酸中HCl的物质的量为:0.2 mol/L×0.006 L=0.001 2 mol.
氨水中NH3的物质的量为:0.1 mol/L×0.01 L=0.001 mol.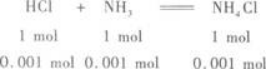
所以,反应后生成NH4Cl 0.001 mol,剩余的HCl为0.001 2 mol-0.001 mol=0.000 2 mol.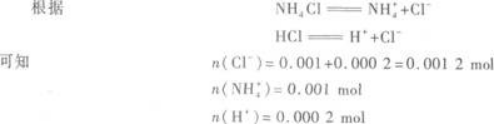
以上物质的量的大小顺序就是离子浓度的大小顺序.
另外,一般情况下,溶液均指水溶液,所以溶液中还有水电离出来的H+和OH-两种离子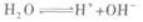
此题中酸有剩余,所以c(H+)一定大于c(OH-).
-
第2题:
已知,在Cl-和CrO42+浓度皆为0.10mol/L的溶液中,逐滴加入AgNO3溶液,情况为()。
- A、Ag2CrO4先沉淀
- B、只有Ag2CrO4沉淀
- C、AgCl先沉淀
- D、同时沉淀
正确答案:C -
第3题:
在含有Cl-和PO43-]的溶液中,逐滴滴加AgNO3溶液,设PO43-的原始浓度 0.1mol/L,计算 Ag3PO4开始沉淀时,[PO43-]与[Cl-]的比值,问用此法是否可将Cl-和PO43-]分离开?
正确答案: 1.[Ksp(Ag3PO4)=1.6×10-21,Ksp(AgCl)=1.6×10-10]
2.不能 -
第4题:
将50ml0.5mol/LFeCl3溶液稀释为0.2mol/L的溶液,需加水()
- A、75ml
- B、100ml
- C、150ml
- D、200ml
- E、250ml
正确答案:A -
第5题:
将10mL5mol/L的HCl溶液加水稀释至200mL,再从中取出10mL,则此10mL溶液的物质的量浓度为()mol/L。
- A、0.05
- B、0.1
- C、0.25
- D、0.5
正确答案:C -
第6题:
下列实验不能成功的是:()。①将乙酸和乙醇混合加热制乙酸乙酯;②苯和浓溴水反应制溴苯;③CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型;④用2mL0.1mol/L的CuSO4溶液和2mL0.1mol/L的NaOH溶液混合,然后加入几滴乙醛,加热,根据是否产生红色沉淀检验醛基。
- A、①②③④
- B、①③④
- C、①②③
- D、②③④
正确答案:A -
第7题:
将5mL10mol/L盐酸稀释为250mL溶液,再从稀释后的溶液中取出10mL溶液的摩尔浓度是().
- A、0.08mol/L
- B、0.2mol/L
- C、0.5mol/L
- D、1mol/L
正确答案:B -
第8题:
某一元弱酸与36.12mL0.100mol·L-1NaOH正好作用完全。然后再加入18.06mL0.100mol·L-1HCl溶液,测得溶液pH=4.92。计算该弱酸的解离常数是()。
正确答案:1.2×10-5 -
第9题:
问答题计算题:取某钻井液样品100ml做氯离子滴定,钻井液样品滤纸过滤后获得10ml,滤液,取2ml滤液做滴定,耗去0.2mol/L的AgNO3溶液30ml,则钻井液样品中所含氯离子为多少?已知:N=0.2mol/L,Q=30ml,V=2ml。求ρ(CL-)正确答案: 根据公式:ρ(CL-)=N·Q/V╳35.5╳103
代入数据得:ρ(CL-)=0.2*30/2*35.5*103=106.5*103(mg/L)
钻井液样品中所含氯离子为106.5*103mg/L。解析: 暂无解析 -
第10题:
单选题向200mL0.1mol/L Na2SO4溶液中加入100mL0.25mol/L的Ba(OH)2溶液后,还需加入多少盐酸才能恰好完全中和( ).A10mL lmol/L盐酸
B5mL lmol/L盐酸
C50mL lmol/L盐酸
D25mL 0.5mol/L盐酸
正确答案: A解析:
Ba(OH)2溶液加入后对氢氧根离子没有消耗,所以溶液中的氢氧根离子的物质的量为为0.05mol,所以需要0.05mol的氢离子来中和. -
第11题:
单选题下列溶液中,跟100mL0.5mol/LNa2SO4溶液所含Na+的物质的量浓度相同的是( ).A200mLl.0mol/L NaCl溶液
B200mL0.5mol/L NaCl溶液
C100mL0.5mol/L NaOH溶液
D50mLl.0mol/L Na2CO3溶液
正确答案: D解析:
100mL0.5mol/L Na2SO4溶液所含Na+的物质的量浓度为1mol/L,A项,为1mol/L;B项,为0.5mol/L;C项为0.5mol/L;D项为2mol/L. -
第12题:
判断题将100mL0.1mol·L-1HAc溶液加到100mL0.1mol·L-1NaOH溶液中,因恰能中和完全,所以混合溶液应显中性。A对
B错
正确答案: 对解析: 暂无解析 -
第13题:
mL BaCl2溶液中所含的Cl-,可被20 mL0.5 mol/L AgNO3溶液完全沉淀,则BaCl2溶液的物质的量浓度为__________mol/L。答案:解析:0.1 -
第14题:
在200mL稀盐酸里有0.73gHCI,则该溶液的物质的量浓度为()。
- A、0.1m0l/L
- B、0.2mOl/L
- C、0.5mOl/L
- D、1.0mOl/L
正确答案:A -
第15题:
往10滴0.02mol·L-1铬钾矾溶液中加入5mL2mol·L-1H2SO4,然后加入0.5mol·L-1KMnO4溶液,写出现象及化学方程式
正确答案: 溶液由紫色变为橙色
10Cr3++6MnO4-+11H2O==5Cr2O7+6Mn2++22H+ -
第16题:
以AgNO3滴定CN-,当加入28.72mL0.0100mol·L-1的AgNO3溶液时刚刚出现沉淀,此沉淀是什么?加入过量CN-银生成什么物质态?问原样中含NaCN多少克
正确答案:AgCN以[Ag(CN)2]-存在
Ag++2CN-==〔Ag(CN)2〕-
2.9×10-4 2×2.9×10-14
Ag+:28.72×0.0100/1000=2.9×10-4mol;NaCN分子量49
原样中含NaCN:2×2.9×10-4×49=0.0284g -
第17题:
将100mL0.1mol·L-1HAc溶液加到100mL0.1mol·L-1NaOH溶液中,因恰能中和完全,所以混合溶液应显中性。
正确答案:错误 -
第18题:
计算题:将0.5000g石灰石试样溶于25ml0.5mol/l盐酸溶液中,用0.25mol/l的氢氧化钠溶液滴定过剩的盐酸溶液,消耗氢氧化钠溶液14ml,试求石灰石中碳酸钙的百分含量并写出反应方程式。(CaCO3的分子量是100)。
正确答案: 解:CaCO3+2HCl==(加热)==CaCl2+H2O+CO2↑
HCl(剩余)+NaOH====NaCl+H2O
与CaCO3反应的HCl的物质的量为n1=(c1V1-c2V2)
CaCO3的物质的量为n2=n1/2
CaCO3的质量为m=n2/M
石灰石中碳酸钙的百分含量w=m/0.5
wCaCO3=(c1V1-c2V2)/2×100×100
(m×1000)
=(0.5×25-0.25×14)×50.0×100/(0.5000×1000)=90% -
第19题:
NaHCO31.008g溶于适量水中,然后往此溶液中加入纯固体NaOH 0.3200g,最后将溶液移入250mL容量瓶中。移取上述溶液50.00mL,以0.100mol·L-1HCl溶液滴定。计算以酚酞为指示剂滴定至终点时,消耗HCl溶液()毫升,继续加入甲基橙指示剂滴定至终点时,又消耗HCl溶液()毫升。
正确答案:16.0;24.0 -
第20题:
用过量的AgNO3沉淀50.0mL稀盐酸中的氯离子,得到0.682g干燥的AgCl,计算稀盐酸的物质的量浓度是()。
正确答案:0.0952mol·L-1 -
第21题:
问答题计算题:将0.5000g石灰石试样溶于25ml0.5mol/l盐酸溶液中,用0.25mol/l的氢氧化钠溶液滴定过剩的盐酸溶液,消耗氢氧化钠溶液14ml,试求石灰石中碳酸钙的百分含量并写出反应方程式。(CaCO3的分子量是100)。正确答案: 解:CaCO3+2HCl==(加热)==CaCl2+H2O+CO2↑
HCl(剩余)+NaOH====NaCl+H2O
与CaCO3反应的HCl的物质的量为n1=(c1V1-c2V2)
CaCO3的物质的量为n2=n1/2
CaCO3的质量为m=n2/M
石灰石中碳酸钙的百分含量w=m/0.5
wCaCO3=(c1V1-c2V2)/2×100×100
(m×1000)
=(0.5×25-0.25×14)×50.0×100/(0.5000×1000)=90%解析: 暂无解析 -
第22题:
单选题将5mL10mol/L盐酸稀释为250mL溶液,再从稀释后的溶液中取出10mL溶液的摩尔浓度是().A0.08mol/L
B0.2mol/L
C0.5mol/L
D1mol/L
正确答案: C解析: 暂无解析 -
第23题:
填空题0.1mol·L-1的RClx溶液10mL,当加入0.05mol·L-1的AgNO3溶液60mL时,恰好完全反应,x值等于____.正确答案: 3解析:
由原子个数守恒.银离子和氯离子最终以氯化银形式沉淀.银离子的物质的量等于氯离子的物质的量.
