金属单质X,常温下液态单质Y和气态单质X,以及化合物A、B、C有如图2—1所示的反应关系:(1)写出化学式:X____________,Y____________,Z____________. (2)写出G→A的离子方程式:____________________________________. (3)A的水溶液呈酸性,其溶于水会使水的电离平衡发生移动,离子方程式为____________________________________。
题目
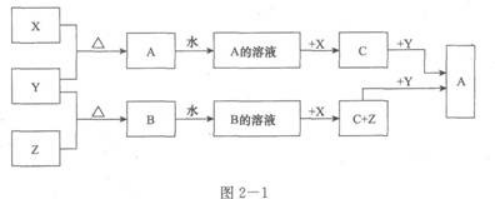
(1)写出化学式:X____________,Y____________,Z____________.
(2)写出G→A的离子方程式:____________________________________.
(3)A的水溶液呈酸性,其溶于水会使水的电离平衡发生移动,离子方程式为____________________________________。
相似考题
参考答案和解析

更多“金属单质X,常温下液态单质Y和气态单质X,以及化合物A、B、C有如图2—1所示的反应关系: (1)写出化学式:X____________,Y____________,Z____________. (2)写出G→A的离子方程式:____________________________________. (3)A的水溶液呈酸性,其溶于水会使水的电离平衡发生移动,离子方程式为____________________________________。”相关问题
-
第1题:
明矾水溶液呈酸性的离子方程式是____________________,出现浑浊时,消除的方法是____________________;纯碱与水作用的离子方程式是____________________,若要增强其洗涤力应____________________.答案:解析:
-
第2题:
元素X的原子序数为14,常温下元素Y的单质是气体,它的原子的最外层电子数为6,则X与Y形 成的化合物是 ( )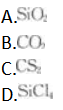 答案:A解析:
答案:A解析: -
第3题:
X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y:X和Z组成原电池时,Z为正极;Y和Z两种离子在同一溶液中被电解时.阴极只能得到Y单质:M离子的氧化性强于Y离子。则这四种金属的活动性由强到弱的顺序是:( )。A、X>Z>Y>M
B、X>Y>Z>M
C、M>Z>X>Y
D、X>Z>M>Y答案:A解析:金属活动性强的单质可以置换出金属活动性较弱的单质,X可以从Y的盐溶液中置换出Y,说明金属活动性X>Y;原电池中,负极金属的活动性较强,X和Z组成原电池时,Z为正极,说明金属活动性X>Z;电解池中。阴极是得电子被还原的一极,氧化性强的最先放电,Y和Z两种离子在同一溶液中被电解时.阴极只能得到Y单质,说明金属活动性Z>Y;M离子的氧化性强于Y离子,说明金属活动性Y>M。这四种金属的活动性顺序为X>Z>Y>M,本题选A。 -
第4题:
右图中的物质都是初中化学常见物质,其中A、B为单质,B是可供动植物呼吸的气体;甲、乙、丙为化合物,甲与过量的丙、乙与过量的丙两两反应的所有产物相同。图中“—”表示两端的物之间能发生化学反应;“→”表 示物质间存在转化关 系;部分反应物或生成物已略去。
(1)写出B的化学式___________________;写出一种丙的名称___________________。
(2)写出A和甲反应的化学方程式:___________________。
(3)写出乙→甲的化学方程式:___________________。答案:解析:(1)O2 氢氧化钠(或氢氧化钙等) (2)C+CO2====2CO (3)H2CO3=CO2↑+H2O -
第5题:
电解含有金属离子的盐类水溶液:Na+,Zn2+,Cu2+,Ag+最先被还原为金属单质的是( )。A.Na+
B.Zn2+
C.Cu2+
D.Ag+答案:D解析:电解产物析出的先后顺序由它们的析出电势来决定。 -
第6题:
弱电解质在水溶液中只有很少一部分分子电离为离子,大部分以()形式存在。
- A、化合物
- B、单质
- C、分子
- D、质子
正确答案:C -
第7题:
写出金属钠在空气中燃烧,生成物溶于水,再滴入KMnO4溶液的反应方程式及反应现象
正确答案:1).空气中燃烧:2Na+O2=Na2O2(黄色)
2).Na2O2溶于水再滴加KMnO4溶液时,出现MnO2沉淀并有氧气放出.
2KMnO4+3Na2O2+4H2O=2MnO2↓+3O2↑+6NaOH+2KOH
3).也可能出现绿色的锰酸盐:
2KMnO4+Na2O2=K2MnO4+Na2MnO4+O2↑ -
第8题:
下列单质或化合物性质的描述正确的是()。
- A、NaHSO4水溶液显示中性
- B、SiO2与酸碱均不反应
- C、NO2溶于水时发生氧化还原反应
- D、Fe在足量的CL2中燃烧生成FeCl2和FeCl3
正确答案:C -
第9题:
常温下呈液态的金属单质为()。
正确答案:汞 -
第10题:
X、Y两元素的质子数之和为22,X的原子核外电子数比Y少6个,下列说法中不正确的是( )
- A、Y的单质是金属晶体
- B、X的单质固态时为分子晶体
- C、X与碳形成的化合物为分子晶体
- D、X与Y形成的化合物固态时为分子晶体
正确答案:A,D -
第11题:
元素X和Y在元素周期素中处于相邻周期,两种元素原子的质子数之和为21,Y元素原子的核外电子数比X元素原子的核外电子数多5。则下列叙述不正确的是()
- A、X和Y两元素形成的化合物在熔融状态下电解可以得到两元素的单质
- B、Y元素的单质不能和金属氧化物反应
- C、X和Y构成一种阴离子,这种阴离子与过量H+反应可以转变为Y元素阳离子
- D、X元素的一种单质能有效地吸收太阳光线中的紫外线
正确答案:B -
第12题:
填空题已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题: (1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:()、()、()、()等。 (2)若X原子的外围电子层排布为3d104s2,Y可能是()元素或()元素(写元素符号)。 (3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:()、()、()、()、()、()、()。正确答案: CO2,SO2,SiO2,CS2,F,Cl,1s2,2s2,3s2,4s2,3d64s2,3d94s2,3d104s2解析: 暂无解析 -
第13题:
元素X、Y、Z都位于短周期,它们的原子序数按X、Y、Z的顺序依次增大。X和Z位于同一主族,Y和Z位于同一周期。Y的单质与2的单质相互作用,生成离子化合物Y2Z。则X原子的结构示意图为__________。Y2Z的电子式为__________。答案:解析: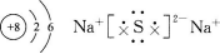
-
第14题:
颗粒大小达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”。
⑴在高温条件下,用H2与FeCl2反应,可生成“纳米铁”和一种溶于水显强酸性的气体,写出该反应的化学方程式( ) 。
⑵“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式( ) 。
⑶请你预测“纳米铁”的其他化学性质,用化学反应方程式表示( ) 。答案:解析:
-
第15题:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和2-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )。.A.原子的最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X>Y>z-
D.原子序数:X>Y>Z答案:D解析:由于x、Y、z均为短周期元素,Y+与z一的电子层结构相同,所以两种元素位于相邻周期,则Y是Na,Z是F,则X是S。原子最外层电子数F>S>Na,A项错误;单质沸点:Na>S>F:,B项错误;离子半径:S2->F>Na十,C项错误;原子序数:S>Na>F,D项正确。故选D。 -
第16题:
工业上以大理石和赤铁矿为主要原料制取B和G,其转化关系如下图所示,已知D、G为单质。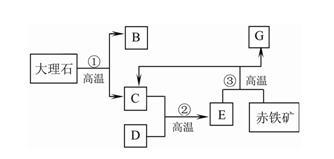
回答下列问题:
⑴写出工业制取的两种物质的化学式:B( ),G ( );
⑵写出反应③的化学方程式:( )。答案:解析:(1)CaO Fe
⑵
-
第17题:
往BaCl2和CaCl2的水溶液中分别依次加入:(1)碳酸铵;(2)醋酸;(3)铬酸钾,各有何现象发生?写出反应方程式。
正确答案: BaCl2+(NH4)2CO3=BaCO3↓+NH4Cl
BaCl2+2CH3COOH=Ba(CH3COO)2↓+2HCl
BaCl2+K2CrO4=BaCrO4↓+2KCl
CaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl
CaCl2+2CH3COOH=Ca(CH3COO)2↓+ 2HCl
CaCl2+K2CrO4=CaCrO4•2H2O↓+2KCl -
第18题:
写出下列反应方程式并注明产物颜色:向K2Cr2O7溶液中加入Ag+离子有()色沉淀生成,其反应式为()
正确答案: 砖红色;Cr2O72-+4Ag++H2O==2H++2Ag2CrO4↓ -
第19题:
CN-被称为拟卤素离子,某些性质与Cl-,Br-等相似。常温下(CN)2与氯单质同碱的反应相似,试推断其产物为()。
正确答案:CN-,OCN- -
第20题:
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答: (1)用化学符号表示下列4种微粒:A:()B:()C://()D://()。 (2)写出A、B、E三种微粒反应的离子方程式:()
正确答案:H2O;NH3;NH4+;OH-;Al3++3NH3+3H2O==Al(OH)3↓+3NH4+、 Mg2++2NH3+2H2O==Mg(OH)2↓+2NH4+ -
第21题:
电解含有下列金属离子的盐类水溶液:Li+、Na+、K+、Zn2+、Ca2+、Ba2+、Ag+。其中()能被还原成金属单质,()不能被还原成金属单质。
正确答案:Zn2+、Ag+;Li+、Na+、K+、Ca2+、Ba2+ -
第22题:
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题: (1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:()、()、()、()等。 (2)若X原子的外围电子层排布为3d104s2,Y可能是()元素或()元素(写元素符号)。 (3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:()、()、()、()、()、()、()。
正确答案:CO2;SO2;SiO2;CS2;F;Cl;1s2;2s2;3s2;4s2;3d64s2;3d94s2;3d104s2 -
第23题:
单选题元素X和Y在元素周期素中处于相邻周期,两种元素原子的质子数之和为21,Y元素原子的核外电子数比X元素原子的核外电子数多5。则下列叙述不正确的是()AX和Y两元素形成的化合物在熔融状态下电解可以得到两元素的单质
BY元素的单质不能和金属氧化物反应
CX和Y构成一种阴离子,这种阴离子与过量H+反应可以转变为Y元素阳离子
DX元素的一种单质能有效地吸收太阳光线中的紫外线
正确答案: D解析: 由题意知,假设X的质子数为X,Y的质子数为Y,则有:X+Y=21,Y-X=5,解得:X=8,Y=13即X为Al,Y为O;故答案为B。
