对于电极反应:Pb2+(aq)+2e-→Pb(s)和1/2Pb2+(aq)+e-→1/2Pb(s),当Pb2+浓度均为1mol/dm3时,若将其分别与标准氢电极组成原电池,则它们的电动势相同。
题目
对于电极反应:Pb2+(aq)+2e-→Pb(s)和1/2Pb2+(aq)+e-→1/2Pb(s),当Pb2+浓度均为1mol/dm3时,若将其分别与标准氢电极组成原电池,则它们的电动势相同。
相似考题
参考答案和解析
更多“对于电极反应:Pb2+(aq)+2e-→Pb(s)和1/2Pb2+(aq)+e-→1/2Pb(s),当Pb2+浓度均为1mol/dm3时,若将其分别与标准氢电极组成原电池,则它们的电动势相同。”相关问题
-
第1题:
下列关于标准电极电位说法错误的是()。A、标准电极电位是相对于标准氢电极而言的
B、标准电极电位是在298.15K下,压力为101.325kPa下测得的
C、标准电极电位涉及到的有关物质浓度均为1mol•L-1
D、气体压力不影响标准电极电位
参考答案:D
-
第2题:
由反应Fe(s)+2Ag+(aq)= Fe2+(aq)+2Ag(s)组成原电池,若仅将Ag+浓度减小到原来浓度的1/10,则电池电动势会( )。
A.增大 0.059V B.减小 0.059V C.减小 0.118V D.增大 0.118V答案:B解析:
-
第3题:
条件电极电位是()。
- A、在特定条件下氧化形和还原形的总浓度均为1mol·L-1或它们的浓度比为1时,在校正各种外界因素的影响后所得的实际电极电位
- B、标准电极电位
- C、任意浓度下的电极电位
- D、任意温度下的电极电位
正确答案:A -
第4题:
把铜片浸入Cu2+浓度为1mol/l的溶液中,和标准氢电极组成原电池,实验测得E电池=0.337伏,则φθCu2+/Cu等于()。
- A、-0.337伏
- B、0
- C、0.337伏
- D、无法计算
正确答案:C -
第5题:
现有酸性KMnO4和Pb(NO2)2溶液各一杯,选金属铂(Pt)棒插入KMnO4溶液中,金属铅(Pb)棒插入Pb(NO2)2溶液中,已知参与反应物质浓度均为1mol.L-1,φΘ(Pb2+/Pb)=-0.126V,φΘ(MnO4-/Mn2+)=+1.491V. (1)试判断该原电池反应自发进行的方向。 (2)完成并配平上述原电池反应方程式,以及两电极反应式。 (3)用电池符号表示该原电池,并计算其标准电动势和平衡常数。
正确答案: (1) 2MnO4-+5Pb+16H+=2Mn2++5Pb2++8H2O
(2) 负极:Pb=Pb2++2e 正极:MnO4-+8H++5e=Mn2++4H2O
(3)(-)Pb/Pb2+// MnO4-,Mn2+/Pt(+) K⊙=10273.1 -
第6题:
已知φ0(Ag+,Ag)=0.799V,φ0(Pb2+,Pb)=-0.126V,在298K、p0下,电解含Ag+、Pb2+活度各为1的溶液,当Pb2+离子开始析出时,Ag+的浓度是:()
- A、10-7mol·dm-3
- B、1mol·dm-3
- C、10-16mol·dm-3
- D、无法计算
正确答案:C -
第7题:
某溶液中含有Pb2+和Zn2+,两者的浓度均为0.10mol·L-1,在室温下通入H2S(g)使之成为饱和溶液,并加HCl控制S2-浓度。为了使PbS沉淀出来,而Zn2+仍留在溶液中,则溶液中的H+浓度最低应是()。此时溶液中的Pb2+为()。
正确答案:0.21;1.2×10-6 -
第8题:
铅电极Pb(汞齐)(a=0.1)|Pb2+(a=1)和Pb|Pb2+(a=1)的电极电势分别为φ1和φ2,则φ1()φ2。
正确答案:〉 -
第9题:
电池(1)Ag|AgBr(s)|KBr(aq)|Br2|Pt,电池(2)Ag|AgNO3(aq)||KBr(aq)|AgBr(s)|Ag的电池电动势E1、E2都与Br-浓度无关。
正确答案:错误 -
第10题:
常用三种甘汞电极,即(1)饱和甘汞电极;(2)摩尔甘汞电极;(3)0.1mol•dm-3甘汞电极。反应式为:Hg2Cl2(s)+2e=2Hg(1)+2Cl-(aq)。25℃时三者的标准电极电位φ相比:()。
- A、φ1〉φ2〉φ3
- B、φ2〉φ1〉φ3
- C、φ3〉φ2〉φ1
- D、φ1=φ2=φ3
正确答案:C -
第11题:
判断题电极反应Fe3+(aq)+e====Fe2+(aq)的ϕθ=+0.771V,则电极反应Fe2+(aq)==== Fe3+(aq)+e的ϕθ=-0.771V。A对
B错
正确答案: 错解析: 暂无解析 -
第12题:
单选题条件电极电位是()。A在特定条件下氧化形和还原形的总浓度均为1mol·L-1或它们的浓度比为1时,在校正各种外界因素的影响后所得的实际电极电位
B标准电极电位
C任意浓度下的电极电位
D任意温度下的电极电位
正确答案: B解析: 暂无解析 -
第13题:
电极相同、电解质也相同的两个半电池,都可以进行电极反应,但溶液的浓度不同,则它们组成的电池的电动势是( )。 答案:D解析:
答案:D解析:
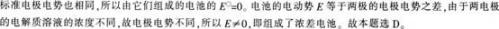
-
第14题:
已知Bi3+和Pb2+与EDTA形成配合物的lgK值分别为27.93和18.04。现在用EDTA分别测定混合试样中Bi3+和Pb2+的含量。下列操作正确的是()。
- A、先调节混合液pH=1,测定Pb2+含量
- B、先调节混合液pH=1,测定Bi3+含量
- C、先调节混合液pH=6,测定Pb2+含量
- D、先调节混合液pH=6,测定Bi3+含量
正确答案:B -
第15题:
标准状态下,用电对Ni2+/Ni和Pb2+/Pb组成原电池,已知(Pb2+/Pb)=-0.1262V;(Ni2++/Ni)=-0.257V;Ksp(PbS)=9.04×10-29;Ksp(NiS)=1.07×10-21;在正极一侧溶液中加入S2-使生成硫化物沉淀并使[S2-]=1mol•L-1,同时维持负极不变,计算此时电池的电动势为()
- A、0.1308V
- B、0.6993V
- C、-0.6993V
- D、-0.1308V
正确答案:C -
第16题:
下列四组组成不同的混合溶液,当把金属铅分别插入各组溶液中组成电池,已知φ0(Pb2+/Pb)=-0.126V,φ0(Sn2+/Sn)=-0.136V,能从溶液中置换出金属锡的是:()
- A、a(Sn2+)=1.0,a(Pb2+)=0.10;
- B、a(Sn2+)=1.0,a(Pb2+)=1.0;
- C、a(Sn2+)=0.1,a(Pb2+)=1.0;
- D、a(Sn2+)=0.5,a(Pb2+)=0.5
正确答案:A -
第17题:
用两铅片分别插入两Pb2+溶液中,做成电极I和II,分别得到电极电位:φI=-0.13V,φII=-0.15V,说明两溶液中[Pb2+]为()
- A、I > II
- B、II > I
- C、I = II
- D、无法判断
正确答案:A -
第18题:
常用的甘汞电极的电极反应:Hg2Cl2(s)+2e-→2Hg(l)+2Cl-(aq),设饱和甘汞电极、摩尔(1mol/dm3)的甘汞电极和0.1mol/dm3甘汞电极的电极电势分别为E1、E2、E3,则298K时三者的相对大小为()
正确答案:E1〈E2〈E3 -
第19题:
溶液中含有浓度均为0.010mol·L-1的Pb2+、Bi3+两种离子,问()(能/否)利用控制酸度的方法单独滴定Bi3+,而Pb2+不干扰。
正确答案:能 -
第20题:
用对消法测定由电极Ag(s)│AgNO3(aq)与电极Ag,AgCl(s)│KCl(aq)组成的电池的电动势,下列哪一项是不能采用的? ()
- A、标准电池
- B、电位计
- C、直流检流计
- D、饱和KCl盐桥
正确答案:D -
第21题:
在“标准电极电势表”中列出的电极电势E°都是指25℃时该电极反应中各物质活度均为1时相对于标准氢电极电势之值。为了精确测定诸电极的E°值,下列方法(均在25℃下进行)可行的是()
- A、精确配制出各电极活性物质的活度为1的溶液组成电池,测定电池的电动势
- B、由电解质活度、电解质离子平均活度及与它们相应的浓度之间的关系,求得电解质活度为1时的浓度,以此配制电解液,进行电动势测量
- C、由实验测定热力学数据(如ΔG°f ), 然后计算E°
- D、配制浓度不同的一系列电解质溶液,测出待定电极与标准氢电极组成的电池的一系列电动势E值,用外推法求出E°
正确答案:D -
第22题:
电极Pb2+(a)|Pb-Hg(a’)和Pb2+(a)|Pb(s)的电极电势和标准电极电势间的关系为:()。
- A、电极电势相同,标准电极电势不同
- B、标准电极电势相同,电极电势不同
- C、标准电极电势和电极电势均相同
- D、标准电极电势和电极电势均不同
正确答案:D -
第23题:
单选题假设规定标准氢电极的电极电势φθ(H+/H2)=1V,则测得下列原电池:(-)Zn|Zn2+(1mol·dm-3)||H+(1mol·dm-3)|H2(pθ)(Pt)(+)的标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)的数值变化为()A标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)各增加1V
B标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)各减少1V
C标准电动势Eθ不变,锌标准电极电势φθ(Zn2+/Zn)增加1V
D标准电动势Eθ不变,锌标准电极电势φθ(Zn2+/Zn)减少1V
E标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)均不变
正确答案: E解析: 暂无解析 -
第24题:
判断题由于Pb2+/Pb电对和Sn2+/Sn电对的标准电极电势非常接近,因此,Pb2+(aq)氧化Sn(s)或Sn2+(aq)氧化Pb(s)的反应都是可能发生的。A对
B错
正确答案: 对解析: 暂无解析
