凡是三原子组成的直线形分子,中心原子是以sp杂化方式成键的。
题目
凡是三原子组成的直线形分子,中心原子是以sp杂化方式成键的。
相似考题
参考答案和解析
更多“凡是三原子组成的直线形分子,中心原子是以sp杂化方式成键的。”相关问题
-
第1题:
下列各分子中,中心原子以sp3杂化轨道成键的是( )。A.NH3(μ≠0)
B.SiC.l4(μ=0)
C.H2O(μ≠0)
D.B.eC.l2(μ=0)答案:B解析:空间构型对称则分子无极性,故μ=0 -
第2题:
下列各种说法中正确的是?
A.凡是中心原子采用sp3杂化轨道成键后形成的分子,其空间构型都是正四面体
B.凡AB3型的共价化合物,其中心原子均采用sp2杂化轨道成键
C.在AB2型的共价化合物中,中心原子均采用sp杂化轨道成键
D. sp3杂化可分等性sp3杂化和不等性sp3杂化答案:D解析:提示:通过sp杂化后形成的分子为直线;通过sp2杂化后形成的分子为正三角形,也有V字形的;通过SP3杂化后形成的分子有正四面体、三角锥形,还有V字形。 -
第3题:
下列分子中,中心原子成键时采用等性sp3杂化的是()
- A、H2O
- B、NH3
- C、SO3
- D、CH4
正确答案:D -
第4题:
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为()。
- A、直线形,sp杂化
- B、三角形,sp2杂化
- C、三角锥形,sp2杂化
- D、三角锥形,sp3杂化
正确答案:D -
第5题:
CH4和NH3分子中心原子都采取sp3杂化,但二者的分子构型不同,为什么?
正确答案:CH4中C采取sp3等性杂化.
∴是正面体构型. NH3中N采取sp3不等性杂化.因有一孤对电子,三个σ键.
∴为三角锥形. -
第6题:
臭氧分子和二氧化硫分子具有类似的V形结构。中心原子都以sp2杂化,原子间除以σ键相连外,还存在∏34的离域π键。结构的主要不同点在于键长,键能和键角不同
正确答案:正确 -
第7题:
气态的三氧化硫主要是以单分子形式存在,中心原子的杂化,成键及分子的结构为()
- A、sp3杂化,σ键,三角锥体
- B、spd2杂化,σ键,平面正方形
- C、sp2杂化,σ键,∏46键,平面三角形
- D、以上三者都不是
正确答案:C -
第8题:
关于NH3分子描述正确的是()。
- A、N原子采取SP2杂化,键角为107.3°;
- B、N原子采取SP3杂化,包含一条σ键三条π键,键角107.3°;
- C、N原子采取SP3杂化,包含一条σ键二条π键,键角109.5°;
- D、N原子采取不等性SP3杂化,分子构形为三角锥形,键角107.3°
正确答案:D -
第9题:
在OF2分子中,氧原子成键的杂化轨道是下列中哪种杂化轨道?()
- A、sp3杂化
- B、sp杂化
- C、sp2杂化
- D、sp3不等性杂化
正确答案:D -
第10题:
胺中的N原子以sp3杂化轨道与其他原子成键。
正确答案:正确 -
第11题:
单选题下列分子中,中心原子不是采用sp3d杂化轨道成键的是( )。AXeF2
BClF3
CSF4
DIF5
正确答案: B解析:
I原子的最外层电子排布为5s25p5,IF5中心原子I采用的是sp3d2杂化轨道类型与5个F原子成键。 -
第12题:
单选题下列关于杂化轨道的一些说法,正确的是()。ACH4分子中的sp3杂化轨道是由H原子的1个s轨道和C原子的3个p轨道混合起来而形成的
Bsp3杂化轨道是由同一原子中的1个ns轨道和3个np轨道混合起来重新组合成的4个新的原子轨道
C凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体
D凡AB3型共价化合物,其中心原子A均采用sp3杂化轨道成键
正确答案: D解析: 暂无解析 -
第13题:
在下列物质的分子中,中心原子采用sp杂化轨道成键,分子空间构型是直线型的是( )。A.
B.
C.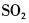
D.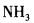 答案:A解析:见杂化轨道类型。中心原子Be采用sp杂化与Cl原子成键。
答案:A解析:见杂化轨道类型。中心原子Be采用sp杂化与Cl原子成键。 -
第14题:
PCl3分子空间几何构型及中心原子杂化类型分别为:A .正四面体,sp3杂化
B.三角锥型,不等性sp3杂化
C .正方形,dsp2杂化
D .正三角形,sp2杂化答案:B解析:提示 P和N为同主族元素,PCl3中P的杂化类型与NH3中的N原子杂化类型相同,为不等性sp3杂化,四个杂化轨道呈四面体型,有一个杂化轨道被孤对电子占据,其余三个杂化轨道与三个Cl原子形成三个共价单键,分子为三角锥型。 -
第15题:
OF2是V字形分子,氧原子成键的轨道类型是()
- A、2个P轨道
- B、sp杂化
- C、sp3不等性杂化
- D、sp2杂化
正确答案:C -
第16题:
关于原子轨道的说法正确的是()
- A、凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体.
- B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的;
- C、sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道;
- D、凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键.
正确答案:C -
第17题:
SnCl2分子和H2O分子的空间构型均为V型,表明它们的中心原子采取相同方式的杂化轨道成键。
正确答案:错误 -
第18题:
凡是配位数为4的分子,其中心原子均采用sp3杂化轨道成键。
正确答案:错误 -
第19题:
[BF4]-中的中心原子的杂化方式是()
- A、sp3
- B、sp2
- C、dsp2
- D、sp3d2
- E、sp3d
正确答案:A -
第20题:
按照杂化轨道理论,在CH4分子中,C原子采用sp3杂化轨道与H原子的1s轨道成键,形成一个空间构型为正四面体的分子。H2O分子中O原子用不等性sp3杂化轨道成键,分子的几何构型是()。
正确答案:V字型 -
第21题:
PCl3分子中,与Cl原子成键的中心原子P采用的原子轨道是:()
- A、px,py,pz
- B、三个sp杂化轨道
- C、三个sp2杂化轨道
- D、三个sp3杂化轨道
正确答案:D -
第22题:
单选题PCl3分子空间几何构型及中心原子杂化类型分别为( )。[2013年真题]A正四面体,sp3杂化
B三角锥形,不等性sp3杂化
C正方形,dsp2杂化
D正三角形,sp2杂化
正确答案: D解析:
P的价电子为3S23P3,存在一对未成键的孤对电子,即3S2轨道上的2个电子。外层一共5个电子中,一对电子占据一个轨道,另外3个电子在P轨道上。3个P轨道与3个Cl的电子成键,这种方式与sp3杂化不同,所以称为不等性SP3杂化,空间构形三角锥。 -
第23题:
单选题下列分子中其中心原子采用sp不等性杂化的是()。ABeCl2
BBCl3
CPH3
DCCl4
正确答案: C解析: 暂无解析
