按照化学反应速率的过渡状态理论,对于气相反应,下列说法不正确的是()A、 该理论不考虑分子的内部结构和分子运动状态 ;B、 反应过程中,反应分子先碰撞形成过渡态 ;C、 活化络合物与反应物之间很快达到平衡 ;D、 反应速率决定于活化络合物的分解速率 ;E、 该理论可以计算出任一反应的速率常数 。
题目
按照化学反应速率的过渡状态理论,对于气相反应,下列说法不正确的是()
- A、 该理论不考虑分子的内部结构和分子运动状态 ;
- B、 反应过程中,反应分子先碰撞形成过渡态 ;
- C、 活化络合物与反应物之间很快达到平衡 ;
- D、 反应速率决定于活化络合物的分解速率 ;
- E、 该理论可以计算出任一反应的速率常数 。
相似考题
更多“按照化学反应速率的过渡状态理论,对于气相反应,下列说法不正确的是”相关问题
-
第1题:
对于一个确定的化学反应来说,下列说法中正确的是( )。
 答案:D解析:
答案:D解析:
分别是热力学函数,与反应速率无关,活化能越低,反应进行得越快。 -
第2题:
高中化学《影响化学反应速率的因素》
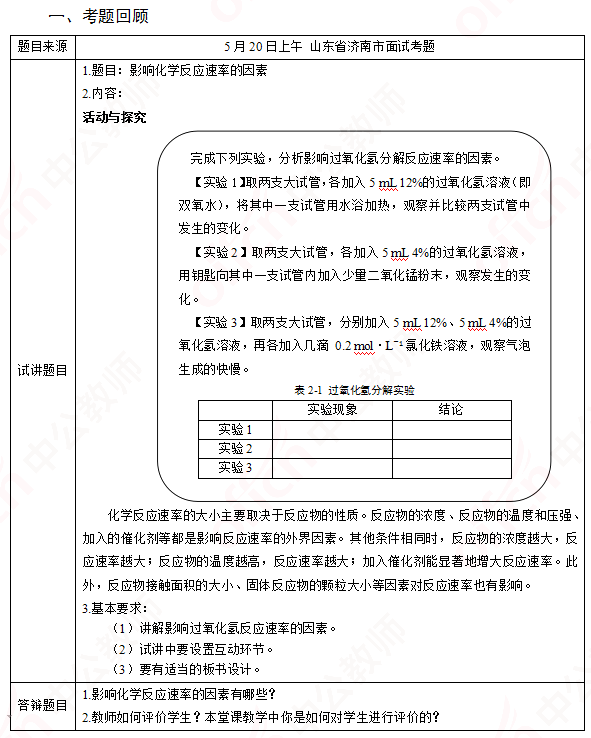
二、考题解析
【教学过程】
(一)图片导入
【展示图片】面包的标签。请学生观察保质期。
【提出问题】根据生活常识知道在不同温度条件下,面包的保质期长短不同,那么温度是如何影响化学反应的快慢?除了温度还有哪些因素会影响化学反应的快慢呢?
(二)探究新知
【展示图片】请学生回忆初中学过的不同金属单质(镁、铝、锌、铁)与稀盐酸的反应。
【提出问题】在外界条件相同的情况下,不同的金属单质与稀盐酸反应,它们的快慢并不相同,这说明了什么?
【学生回答,教师总结】决定化学反应快慢的主要因素是反应物本身的性质。
【教师引导】那么外界条件对化学反应速率的影响是怎样的呢?能不能通过实验验证温度、催化剂、浓度对化学反应速率的影响呢?请同学们利用实验台上的药品、仪器等设计实验。接下来同学们以分好的实验小组为单位,讨论一下如何设计实验,7分钟之后请小组代表回答设计的方案。
(学生小组讨论环节)
【学生回答】①温度对化学反应速率的影响:控制其他外界条件相同,观察相同浓度的双氧水在不同温度下分解的反应速率;
②催化剂对化学反应速率的影响:控制其他外界条件相同,观察相同浓度的双氧水分别加入催化剂、不加入催化剂的反应速率;
③浓度对化学反应速率的影响:观察不同浓度的双氧水在相同条件的反应速率。
【教师引导】在做实验的时候注意控制好外界条件,各个小组按照自己小组设计的实验方案来进行实验,在实验的时候注意观察实验现象,并由此判断外界条件对化学反应速率的影响是怎样的。
(学生分组实验环节,教师巡视指导。)
【学生回答,小组总结】①温度对化学反应速率的影响:温度影响化学反应的速率,温度越高化学反应速率越快,反之越慢;
②催化剂对化学反应速率的影响:催化剂影响化学反应的速率,催化剂可以大大加快反应的速率;
③浓度对化学反应速率的影响:浓度影响化学反应的速率,浓度越大反应速率越大。
【提出问题】下列事实中,什么因素影响了化学反应的速率?
(1)铁矿石炼铁时要粉碎成矿粒。
(2)实验室进行化学反应时,常常把一些固体物质溶于水配成溶液再进行反应。
(3)工业合成氨,通常在2×107~5×107Pa的压强下进行。
【小组回答】
①反应物表面积:有固体参加的反应,固体的表面积越大,化学反应速率越快。
②反应物状态:通常气相或液相反应比固相反应的反应速率大。
③压强:对于有气体参加的反应,改变压强将使气体的体积发生改变,即相应地改变气体的浓度。
(三)拓展提升
【教师提问】在超市,为什么有很多的食品放置在冰柜当中,有什么作用?
【学生回答】通过降低温度有助于减慢化学反应速率,防止食品变质。
(四)小结作业
小结:总结影响化学反应速率的因素。
作业:调查生活生产中改变外界因素调节反应速率的实例,并用化学知识解释。

【答辩题目解析】
1.影响化学反应速率的因素有哪些?
2.教师如何评价学生?本堂课教学中你是如何对学生进行评价的?答案:解析:1、影响化学反应的速率分为内因和外因。内因是影响化学反应速率的本质也就是物质本身的性质,外因有反应物的浓度、温度、压强、催化剂。另外反应物的状态,比如块状还是粉末状,有没有搅拌等也会影响化学反应的速率。
2、新课改理念要求教师注重对学生的情感、态度、价值观等方面进行综合评价。“评价”是学校教育教学活动中的一个重要环节。学校要建立评价学生全面发展的指标体系,不仅要关注学生的学业成绩,而且要注重发展和发现学生多方面的潜能和特长,如学生的道德品质、学习的愿望和能力、交流与合作、个性与情感以及创新意识和实践能力等。要采用灵活多样、具有开放性的评价方法,要关注过程性评价,帮助学生认识自我、建立自信,激发其内在的发展动力,使学生全面发展健康成长。本节课通过启发式的提问,引导学生思考,对于思考速度稍慢的同学我会耐心指导,在小组讨论中,我也会下去巡视,时时关注学生的讨论情况,并及时纠正和引导。 -
第3题:
关于反应速率的有效碰撞理论要点,下列说法不正确的是()。
- A、为了发生化学反应,反应物分子必须碰撞
- B、只有具有足够高的能量的哪些分子的碰撞才能发生反应
- C、对活化分子不需要具备一定的能量
- D、只有沿着特定方向碰撞才能发生反应
正确答案:C -
第4题:
对于气—固相催化反应,要测定真实的反应速率,必须首先排除()和()的影响。
正确答案:内扩散;外扩散 -
第5题:
下列说法中正确的是()。
- A、可逆反应的特征是正反应速率和逆反应速率相等
- B、在其它条件不变时,升高温度可以使化学平衡向放热反应的方向移动
- C、在其它条件不变时,增大压强一定会破坏气体反应的平衡状态
- D、在其它条件不变时,使用催化剂可改变化学反应速率,但不能改变化学平衡状态
正确答案:D -
第6题:
对于反应,当温度不变时,化学反应速率与各反应物浓度幂的乘积成正比。
正确答案:错误 -
第7题:
在液膜分离技术中,关于内相化学反应促进迁移,下列说法正确的是()。
- A、分离具有选择性
- B、分离速率取决内相化学试剂与溶质反应速率
- C、推动力为浓度差
- D、无浓缩效应
正确答案:B,C -
第8题:
在一定温度下,对于某化学反应,随着反应的进行,反应速率逐渐减慢,反应速率常数逐渐变小。
正确答案:错误 -
第9题:
对于一个化学反应来说,在下列说法中的那一种是正确的()。
- A、ΔS0越负,反应速率越快
- B、ΔH越负,反应速率越快
- C、活化能越大,反应速度越快
- D、活化能越小,反应速度越快
正确答案:D -
第10题:
对于一般化学反应,当温度升高时,下列说法正确的是()。
- A、活化能明显降低
- B、平衡常数一定变大
- C、正、逆反应的速率系数成正比
- D、反应到达平衡的时间变短
正确答案:D -
第11题:
单选题对给定的化学反应,下列说法正确的是()。AΔG越负,反应速率越快
BΔH越负,反应速率越快
CΔS越负,反应速率越快
D活化能Ea越小,反应速率越快
正确答案: C解析: 暂无解析 -
第12题:
多选题在液膜分离技术中,关于内相化学反应促进迁移,下列说法正确的是()。A分离具有选择性
B分离速率取决内相化学试剂与溶质反应速率
C推动力为浓度差
D无浓缩效应
正确答案: B,D解析: 暂无解析 -
第13题:
下列说法不正确的是( )A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.增大反应物浓度,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大答案:C解析:A.增大压强,增大单位体积内活化分子个数,从而增大有效碰撞几率,导致反应速率增大,故A正确;
B.升高温度,增大活化分子百分数,从而增大有效碰撞几率,导致反应速率增大,故B正确;
C.增大反应物浓度,增大单位体积内活化分子个数,从而增大有效碰撞几率,反应速率增大,故C错误;
D.使用催化剂,增大活化分子百分数,从而增大有效碰撞几率,反应速率增大,故D正确;
故选C. -
第14题:
在化学反应达到平衡时,下列选项不正确的是()。
- A、反应速率始终在变化
- B、反应速率不再发生变化
- C、反应不再进行
- D、无法确定
正确答案:A,C,D -
第15题:
对于一个化学反应,下列说法中正确的是()
- A、加入催化剂只能使正反应速率越大
- B、加入催化剂只能使逆反应速率越大
- C、活化能越大,反应速率越大
- D、活化能越小,反应速率越大
正确答案:D -
第16题:
对于零级反应,增加反应物的浓度可提高化学反应速率。
正确答案:错误 -
第17题:
简述气相色谱法的速率理论。
正确答案: 速率理论是从动力学观点出发,根据基本的实验事实研究各种操作条件(载气的性质及流速、固定液的液膜厚度、载体颗粒的直径、色谱柱填充的均匀程度等)对理论塔板高度的影响,从而解释在色谱柱中色谱峰形扩张的原因。 -
第18题:
对于一个确定的化学反应来说,下列说法中正确的是:()
- A、ΔrGm°越负,反应速率越快
- B、ΔrSm°越正,反应速率越快
- C、ΔrHm°越负,反应速率越快
- D、活化能越小,反应速率越快
正确答案:D -
第19题:
对于一个化学反应,下列说法中正确的是()
- A、ΔH越负,反应速率越快
- B、活化能越小,反应速率越快
- C、活化能越大反应速率越快
- D、ΔS越负,反应速率越快
正确答案:B -
第20题:
反应速率理论中过渡态理论的要点。
正确答案:化学反应的完成要经过由反应物分子构成的过渡态, 此过渡态称为活化络合物, 形成活化络合物需要一定的能量, 活化络合物与反应物分子之间建立化学平衡, 反应的总速率由活化络合物转化成产物的速率决定。 -
第21题:
对于光化学反应,下列说法错误的是()。
- A、反应的速率基本不受温度的影响,甚至有负温度系数现象
- B、反应初级过程的量子效率等于1
- C、光化学反应的平衡常数等于热化学反应的平衡常数
正确答案:A -
第22题:
单选题对于一个化学反应,下列说法中正确的是()A加入催化剂只能使正反应速率越大
B加入催化剂只能使逆反应速率越大
C活化能越大,反应速率越大
D活化能越小,反应速率越大
正确答案: A解析: 暂无解析 -
第23题:
单选题关于反应速率的有效碰撞理论要点,下列说法不正确的是()。A为了发生化学反应,反应物分子必须碰撞
B只有具有足够高的能量的哪些分子的碰撞才能发生反应
C对活化分子不需要具备一定的能量
D只有沿着特定方向碰撞才能发生反应
正确答案: D解析: 暂无解析
