填空题如果要在一块铜片上用电镀的方法镀上一层锌,应该把锌片放在()。
题目
填空题
如果要在一块铜片上用电镀的方法镀上一层锌,应该把锌片放在()。
相似考题
更多“如果要在一块铜片上用电镀的方法镀上一层锌,应该把锌片放在()。”相关问题
-
第1题:
将纯锌片和纯铜片按图3所示方式插入同浓度的稀硫酸中,下列叙述正确的是( )。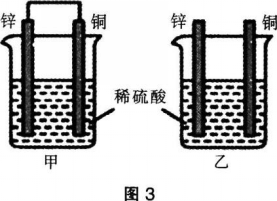 A.两烧杯中铜片表面均无气泡产生
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是阳极.锌片是阴极
C.一段时间后两烧杯中溶液的pH均增大
D.甲产生气泡的速度比乙慢答案:C解析:甲可形成原电池,锌片为负极,铜片为正极,在正极处氢离子得电子产生氢气,有气泡产生。A、B两项错误。甲、乙均消耗稀硫酸,放出氢气,故氢离子浓度均减小,pH增大,C项正确。原电池能加快氧化还原反应的速率,因此甲产生气泡的速度比乙快,D项错误。 -
第2题:
常用的止水片材料有金属材料不包括()A、紫铜片
B、不锈钢片
C、铝片
D、锌片答案:D解析:常用的止水片材料有金属材料:紫铜片、不锈钢片、铝片 -
第3题:
汽油的腐蚀性通常是用()腐蚀来测定的。
- A、铝片
- B、锌片
- C、铜片
- D、铁片
正确答案:C -
第4题:
用西餐完毕时刀叉摆放方法应该是:()
- A、并排放在盘子上
- B、交叉放在盘子上
- C、随意放在桌子上
- D、放在餐巾纸上
正确答案:B -
第5题:
如果要在一块铜片上用电镀的方法镀上一层锌,应该把锌片放在哪里?
正确答案: 应该把锌片放在阳极 -
第6题:
铜片和锌片一同浸在硫酸溶液中,可以看到()。
- A、锌片上有氢气产生
- B、铜片上有氢气产生
- C、两块金属片上都有氢气产生
- D、两块金属片上都没有氢气产生
正确答案:A -
第7题:
当铜片和锌片浸入稀H2SO4中并且用导线联结形成原电池时,产生的现象是()
- A、铜片上有氢气产生
- B、锌片上有氢气产生
- C、铜片溶解
- D、不会有任何变化
正确答案:A -
第8题:
铜片和锌片一同浸在稀硫酸溶液中并用导线连接,这时会发现()。
- A、锌片上有氢气产生
- B、铜片上有氢气产生
- C、两块金属片上都有氢气产生
- D、两块金属片上都没有氢气产生
正确答案:B -
第9题:
如果要在一块铜片上用电镀的方法镀上一层锌,应该把锌片放在()。
正确答案:阳极 -
第10题:
为了防止铁生锈,分别电镀上一层锌和一层锡,两者防腐的效果是否一样?
正确答案:在镀层没有被破坏之前,两种防腐的效果是一样的,镀层都起了将铁与环境中的酸性气体和水隔离的目的,防止微电池的形成,防止了铁被电化腐蚀。但是镀层一旦有破损,则两者的防腐效果就大不相同。
镀锡铁俗称马口铁,锡不如铁活泼。若将锡与铁组成原电池,则锡作阴极,称为阴极保护层,而铁作阳极,这样铁被腐蚀得更快。
镀锌铁俗称白铁,锌比铁活泼,组成原电池时,锌作阳极,称为阳极保护层,锌被氧化,而铁作阴极,仍不会被腐蚀。 -
第11题:
问答题将铜片和锌片插在3%NaCl溶液中,测得铜片和锌片未接通时的电位分别为+0.05V和–0.83V。当用导线通过电流表把铜片和锌片接通,原电池开始工作,电流表指示的稳定电流为0.15mA。已知电路的欧姆电阻为200 。原电池工作后阳极和阴极的电位差Ec–Ea=?正确答案: 根据Ec-Ea=IR
则有:Ec-Ea=IR=0.51mA×200欧=30mV=0.03V
即原电池工作后阳极和阴极的电压差Ec-Ea=0.03V解析: 暂无解析 -
第12题:
单选题用西餐完毕时刀叉摆放方法应该是:()A并排放在盘子上
B交叉放在盘子上
C随意放在桌子上
D放在餐巾纸上
正确答案: D解析: 暂无解析 -
第13题:
案例:
下面是两位中学教师关于“原电池”的教学过程实录。
李老师的教学实录?
【课堂引入】你曾亲身体验趣味实验的神奇吗?你有积极参与趣味实验的兴趣吗?那么请你来亲身体验吧。
【学生】学生用舌尖感受水果电池的电流。
【老师提问】你有什么感觉吗,你的观点是什么呢?
【学生回答】有麻麻的感觉,好像有电。
【课堂投影】1780年意大利解剖学家伽伐尼在做青蛙解剖实验,引导学生做如下实验。
第一步:把一块锌片和铜片分别插入盛有稀硫酸的烧杯里。
第二步:用导线将锌片和铜片连接起来。
第三步:在导线中接入一个灵敏电流计。
【老师】在实验过程中,老师引导学生仔细观察每一个步骤,善于提问、善于分析总结,在实验的过程中学生提出了一系列的问题:
(1)电流表为什么偏向铜?
(2)导线连起来后为什么铜极上有气泡?
(3)电极移动为什么电流表会有变化?……
【课堂投影】利用flash动画向学生展示原电池工作的微观机理。
【得出结论】原电池形成的实质:氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移给氧化剂。
【课堂过渡】明白了原电池工作原理,但是原电池形成条件又是怎样呢?
【学生实验】组建四个小组,分别探究原电池形成条件。
【实验结论】四个小组经过认真的实验和分析,通过讨论交流,最终得出原电池形成的条件。
王老师的教学实录?
【视频】播放水果电池充电?
【提示】这个视频你看到了什么?我们知道化学反应一般都伴随着能量的产生,有的转化为热能,有的转化为光能,这个过程中能量是如何进行转换的呢?
【板书】一、原电池的定义:将化学能转化为电能的装置。
【过渡】原电池究竟是如何将化学能转化为电能的呢?今天让我们走上科学的探索之路,首先我们来看一组实验。
【实验】我们一起看以下四组实验现象:第一个实验是将锌片放入硫酸溶液中;第二个实验是将铜片放入硫酸溶液;第三个实验是将锌片和铜片平行插入硫酸溶液中:第四个实验是将锌片和铜片接触放入硫酸溶液中。
【学生】观察实验现象。
【设问】大家就各个实验现象进行解释。
【生1】第一个实验锌片放入硫酸溶液中有气泡产生,是因为锌与硫酸发生置换反应,生成了氢气。
【生2】第二个实验铜片放入硫酸溶液无气泡产生,是因为铜不活泼,不能置换出氢气。
【生3】第三个实验锌片和铜片平行插入硫酸溶液中锌片上有气泡产生,铜片上没有气泡产生,是因为锌与硫酸发生置换反应,生成的氢气,铜不活泼,不能置换出氢气。
【生4】第四个实验是将锌片和铜片接触放入硫酸溶液中,铜片上有气泡产生,锌片上没有气泡产生,应该是铜与硫酸发生置换反应。
【生5】如果可能是铜与硫酸反应,那么实验中有Cu2+,溶液应该变为蓝色,但是实验中溶液没有变成蓝色.所以应该是锌与硫酸发生反应。
【老师】学生对前三个实验的解释很正确,那么对于第四个实验,有学生说是锌与硫酸发生反应。那么为什么在铜片上产生了气泡.而不是在锌片。
【学生讨论】因为锌把电子转移到铜片上。
【提问】电子从何而来?电子是从溶液传递还是锌片与铜片的接触点传递的呢?
【回答】是接触点传递的,如果是溶液传递的,电子应该可以传递到铜的表面的,第三个实验应该铜片表面会产生气泡。
【讲述】如果有电子的移动就应该会有电流,那电流是如何产生的呢?
【过渡】下面我们通过实验来验证:将锌片和铜片用导线连接起来,在导线之间接入灯泡。平行插入稀硫酸溶液中观察实验现象。(注意观察铜片表面的变化)我们一起来分析一下电流的产生原理。
【多媒体展示】Cu-Zn原电池闭合状态下微观粒子运动的动画模拟与实验4相似.并展示Cu片、Zn片上得失电子的反应式。
【讲述】在这个装置中锌片失去电子、失去的电子通过导线传递给铜片,溶液中的H+在铜片的表面得到电子变成氢气,该装置发生了化学反应在外电路产生了电流,电子由Zn片流出,产生了电能?
【过渡】原电池的组成部分有哪些?那么原电池的形成条件是怎样的呢?(改变实验的一个因子)
【引导】让学生认识到实验中三个变量之间的关系:①电极材料:同种电极与不同种电极;②电解质溶液:电解质与非电解质;③通络:闭合回路的形成。暗示以此确定设计实验的探究方向。
【讲解】上面,我们通过实验探究了原电池的工作原理,初步形成原电池的概念,那么,原电池是由哪些部分组成的?也即原电池的构成条件是什么?
【探究一】电极的探究?
【探究二】电路的探究?
【学生活动】学生分组总结汇报实验结果和实验结论,师生共同交流探讨,得出结论?
【板书】略。答案:解析:(1)两位老师在化学课堂上所用的教学方法有讲授法、观察一演示法、讨论法和探究法。
李老师在课堂导入环节运用了实验导入、化学史导入、录像导入等多种导入方法相结合的导入方式,充分激发出学生的学习动机,引起了学生的学习兴趣。
王老师在讲解原电池的组成部分和原电池的形成条件知识时运用了对比实验.改变实验中的一个因子来看实验结果,探究过程清晰明了,使学生能够更深入地理解相关知识。
(2)化学课堂导人的要求有科学性原则、相关性原则、趣味性原则、启发性原则、适度性原则。
(3)化学课堂中实验探究的基本教学思路为:问题—探究—反思。 -
第14题:
铠装电缆用镀锌钢带是用冷轧钢带镀上锌层制成的。
正确答案:正确 -
第15题:
铜片腐蚀试验法的实质是把一块一定规格的铜片磨光,用溶剂洗涤晾干后浸入试油中,加热到一定温度并保持一定时间后,取出铜片,根据其颜色变化来定性地检查()。
正确答案:活性硫化物或游离硫 -
第16题:
我们的面板采用的电镀上色的工艺。()
正确答案:错误 -
第17题:
带钢表面镀上锌后,生成的()与锌液结晶时产生晶核的数目和结晶时间有关。
正确答案:锌花大小 -
第18题:
在锌片与铜片相连形成的原电池中,锌片是负极,铜片是正极。
正确答案:正确 -
第19题:
用西餐完毕时刀叉摆放方法应该是()。
- A、并排放在盘子上
- B、交叉放在盘子上
- C、随意放在桌子上
正确答案:B -
第20题:
应用电解原理,在金属或非金属表面,镀上一层其他金属的过程,叫()。电镀中,通常将镀件金属作()极,用含有()离子的溶液作电解质。
正确答案:电镀;阴、欲镀金属 -
第21题:
一贮水铁箱上被腐蚀了一个洞,今用一金属片焊接在洞外面以堵漏,为了延长铁箱的寿命,选用哪种金属片为好?()
- A、铜片
- B、铁片
- C、镀锡铁片
- D、锌片
正确答案:D -
第22题:
为了防止铁生锈,分别电镀上一层锌和一层锡,两者防腐效果是否一样?
正确答案: 在镀层没有被破坏之前,两种防腐的效果是一样的。但是镀层一旦有破损,则防腐效果就大不相同。
镀锡铁俗称马口铁,锡没有铁活泼,组成原电池,锡作阴极,称为阴极保护层,而铁作阳极,这样腐蚀得更快;
镀锌铁俗称白铁,锌比铁活泼,组成原电池时锌作阳极,称为阳极保护层,锌氧化,铁作阴极,仍不被腐蚀。 -
第23题:
单选题用西餐完毕时刀叉摆放方法应该是()。A并排放在盘子上
B交叉放在盘子上
C随意放在桌子上
正确答案: A解析: 暂无解析
