单选题以下实验能确定某溶液中一定含有SO42-的是( ).A 加入硝酸酸化,再加入BaCl2溶液,产生白色沉淀B 加入硫酸酸化,再加入BaCl2溶液,产生白色沉淀C 加入用盐酸酸化的Ba(NO3)2溶液,产生白色沉淀D 加入Ba(NO3)2溶液,产生白色沉淀,再加入盐酸或硝酸,无反应现象
题目
加入硝酸酸化,再加入BaCl2溶液,产生白色沉淀
加入硫酸酸化,再加入BaCl2溶液,产生白色沉淀
加入用盐酸酸化的Ba(NO3)2溶液,产生白色沉淀
加入Ba(NO3)2溶液,产生白色沉淀,再加入盐酸或硝酸,无反应现象
相似考题
更多“以下实验能确定某溶液中一定含有SO42-的是( ).”相关问题
-
第1题:
下列各组离子中,能大量共存于同一溶液中的是( )。
A.C032-、H+、Na+、NO3-
B.NO3-、SO42-、K+、Na+
C.H+、Ag+.SO42-、Cl-
D.Na+、NH+、CI-、OH-
正确答案:B
-
第2题:
下列说法错误的是A.硫酸铵化肥加入熟石灰研磨能嗅到刺激性气味
B.含Cl-的盐溶液能与AgNO3溶液反应,产生白色沉淀
C.含SO42-的盐溶液能与Ba(NO3)2溶液反应,产生白色沉淀
D.某盐能与盐酸反应放出使澄清石灰水变浑浊的气体,该盐一定是含有CO32-的盐答案:D解析: -
第3题:
检验某未知溶液中是否含有SO42-的下列操作中,合理的是()。
- A、先加硝酸酸化,再加氯化钡溶液
- B、先加硝酸酸化,再加硝酸钡溶液
- C、先加盐酸酸化,再加氯化钡溶液
- D、先加盐酸酸化,再加硝酸钡溶液
正确答案:C -
第4题:
溶液中含有S2-,SO42-,CO32-,Cl-,NO3-等离子如何检出?
正确答案: (1)取部分样品,用盐酸酸化后,如产生气体,气体能使湿润的醋酸铅试纸变黑,则样品中含有S2-,若气体能使Ba(OH)2溶液变混浊,则样品含有CO32-。
(2)另取部分样品,用硝酸酸化后(a)取一部分加入AgNO3溶液,如出现白色混浊,则样品中含有Cl;(b)另一部分中加入BaCl2溶液,若出现白色混浊,则样品中含有SO42-。
(3)另取样品,加FeSO4晶体数粒,再慢慢滴加浓硫酸,若出现棕色环,则样品中含有NO3-。 -
第5题:
在只含有Cl-和Ag+的溶液中,能产生AgCl沉淀的条件是()。
- A、离子积﹥溶度积
- B、离子积﹤溶度积
- C、离子积=溶度积
- D、不能确定
正确答案:A -
第6题:
ROH型的强碱性离子交换器中,自上而下地通过含有SO42-的水时,交换带内越往下,水中的SO42-浓度越()。
- A、小
- B、大
- C、不变
- D、不能确定
正确答案:A -
第7题:
下列性质中,可以证明某化合物内一定存在离子键的是()。
- A、可溶于水
- B、具有较高的熔点
- C、熔融状态能导电
- D、水溶液能导电
正确答案:C -
第8题:
在BaSO4饱和溶液中,加入BaCl2,利用同离子效应使BaSO4的溶解度降低,体系中c(SO42-)的变化是:()
- A、增大
- B、减小
- C、不变
- D、不能确定
正确答案:B -
第9题:
单选题下列离子的检验方法合理的是()。A向某溶液中滴加KSCN溶液呈红色,说明不含Fe2+
B向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
正确答案: C解析: 暂无解析 -
第10题:
单选题下列说法中正确的是( ).A浓溶液不一定是饱和溶液
B浓溶液一定是不饱和溶液
C稀溶液一定比浓溶液含有较少的溶质
D稀溶液一定是不饱和溶液
正确答案: C解析:
AB两项,浓溶液是指含有溶质相对较多的溶液,饱和溶液是指在一定温度下,一定量的溶剂里,不能继续溶解某种溶质的溶液,二者无必然的联系;CD两项,稀溶液是指含有溶质相对较少的溶液,不饱和溶液是指在一定温度下,一定量的溶剂里,还能继续溶解某种溶质的溶液,二者无必然的联系. -
第11题:
问答题某同学在实验室里做了这样一个实验:他先向可能含有SO42-的溶液中加入BaCl2溶液,待生成白色沉淀后,又加入稀硝酸,该沉淀不溶解,于是他判定该溶液中一定含有SO42-。该同学的判断是否正确?为什么?正确检验SO42-的实验方法是什么?正确答案: 不正确。
因为用BaCl2鉴定SO42-时,若溶液中含有Ag+,则也会有AgCl的白色沉淀生成,且该沉淀也不溶于稀硝酸,故该同学的鉴别方法不正确。
正确的方法应该向未知溶液中加入Ba(NO3)2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则证明该溶液中一定含有SO42-解析: 暂无解析 -
第12题:
单选题某溶液可能含有Cl-、SO42-,为了检验它们,正确的操作是( ).A先加氯化钠溶液(若有沉淀则滤去),再加硝酸银溶液
B先加硝酸银溶液(若有沉淀则滤去),再加氯化钠溶液
C先加硝酸钡溶液(若有沉淀则滤去),再加硝酸银溶液
D先加硝酸银溶液(若有沉淀则滤去),再加硝酸钡溶液
正确答案: C解析:
可与Cl-产生沉淀的是Ag+,可与SO42-产生沉淀的是Ba2+、Ag+,为了不混淆,则应先加入Ba2+,而后加入Ag+,而加入的溶液中不能含有会对结果产生影响的离子,因此阴离子选择NO3-,故先加硝酸钡溶液(若有沉淀则滤去),再加硝酸银溶液. -
第13题:
在BaSO4饱和溶液中,加入BaCl2,利用同离子效应使BaSO4的溶解度降低,体系中c(SO42-)的变化是:A.增大
B.减小
C.不变
D.不能确定答案:B解析:提示:在BaSO4饱和溶液中,存在BaSO4=Ba2++SO42-平衡,加入BaCl2,溶液中Ba2+增加,平衡向左移动,SO42-的浓度减小。 -
第14题:
某化学教师在一次化学测验中设计了下列试题.并对部分学生的考试结果进行了统计和分析。
【试题】已知一包白色粉末可能含有的成分是CuS04、CaC03、BaCl2、Na2S04、NaOH。为探究其组成,进行以下实验: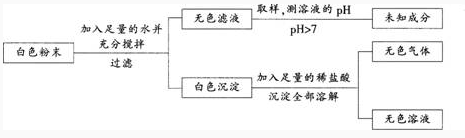
根据以上实验,可以判断白色粉末中,一定含有的物质是什么?一定没有的物质是什么?
【考试结果】很多学生提交了如下答案:肯定含有的物质是CaC03、NaOH,一定没有的物质是CuS04、BaCl2、Na2S04。
根据上述信息,回答下列问题:
(1)本题中白色粉末中一定含有的物质是什么?一定没有的物质是什么?
(2)试对学生答题错误的原因进行分析和诊断。
(3)为了进一步确定该白色粉末中物质的真实组成,还需要做的实验及其现象是什么?答案:解析:【知识点】化学教学评价能力——物质推断
(1)白色粉末中一定含有的物质是CaC03、NaOH,一定没有的物质是CuS04。
(2)产生错误的原因:学生知道BaCl2和Na2S04反应会生成不溶于稀盐酸的沉淀,而认为白色粉末中一定没有BaCl2和Na2S04。但学生忽略了固体粉末中可能含有BaCl2或Na2S04中的一种,因而只从上述实验并不能确定是否含有BaCl2或Na2S04,一定没有的物质也并不包括BaCl2和Na2S04。
(3)①取未知成分溶液少许,加入氯化钡溶液.若有白色沉淀,则白色粉末中含有硫酸钠.若没有沉淀,则白色粉末中不含硫酸钠;②取未知成分溶液少许。加入硫酸钠溶液,若有白色沉淀,则白色粉末中含有氯化钡,若没有白色沉淀,则白色粉末中不含氯化钡。 -
第15题:
NA为阿伏加德罗常数,下列对0.3mol/L的22SO4溶液的说法中,正确的是()
- A、1L溶液中含0.3NA个钾离子
- B、1L溶液中含0.9NA个离子(K+、SO42-)
- C、2L溶液中钾离子浓度是1.2mol/L
- D、2L溶液中含0.6NA个离子(K+、SO42-)
正确答案:B -
第16题:
下列各组离子中,能大量共存于同一溶液中的是()
- A、CO32-、H+、Na+、NO3-;
- B、NO3-、SO42-、K+、Na+;
- C、H+、Ag+、SO42-、Cl-;
- D、Na+、NH4+、Cl-、OH-
正确答案:B -
第17题:
在酸性溶液中,K+、I、SO42-、MnO4-可以共存。
正确答案:错误 -
第18题:
NA为阿伏加德罗常数,下列关于0.2mol/LK2SO4溶液的正确说法是()
- A、500mL溶液中所含K+、SO42-总数为0.3NA
- B、500mL溶液中含有0.1NA个K+离子
- C、1L溶液中K+离子浓度是0.2mol/L
- D、2L溶液中SO42-离子浓度是0.4mol/L
正确答案:A -
第19题:
向含有一定浓度的()水溶液中通入气体即可产生泡沫。
正确答案:表面活性剂 -
第20题:
某溶液中含SO42-、Mg2+两种离子,欲用重量法测定,试拟定简要方案。
正确答案: 先在稀HCl介质中加过量的BaCl2溶液,使SO42-沉淀完全,分离、洗涤、烘干、灼烧后测SO42-含量。然后在滤液中加入PO43-(磷酸三甲酯),或加入(NH3)2HPO4,生成MNH4HPO4沉淀,称量形式MgP2O7,测定Mg2+含量。 -
第21题:
问答题某溶液中含SO42-、Mg2+两种离子,欲用重量法测定,试拟定简要方案。正确答案: 先在稀HCl介质中加过量的BaCl2溶液,使SO42-沉淀完全,分离、洗涤、烘干、灼烧后测SO42-含量。然后在滤液中加入PO43-(磷酸三甲酯),或加入(NH3)2HPO4,生成MNH4HPO4沉淀,称量形式MgP2O7,测定Mg2+含量。解析: 暂无解析 -
第22题:
填空题某混合物中可能含有甲酸、乙酸、甲醇及甲酸乙酯等物质中的一种或几种,在检验时有以下现象:(1)有银镜反应;(2)加入新制的Cu(OH)2悬浊液,无变澄清的现象;(3)与含碱的酚酞溶液共热,发现溶液中红色逐渐变浅以至无色.根据上述现象,可以判断此混合物中一定含有____,可能含有____,一定没有____.正确答案: 甲酸乙酯,甲醇,甲酸、乙酸解析:
有银镜反应,说明分子结构中含有醛基,可能含甲酸、甲酸乙酯;加入新制氢氧化铜悬浊液少许,沉淀不溶解,说明不含羧酸,不含甲酸、乙酸.与含酚酞的氢氧化钠溶液共热,红色逐渐消失,说明和氢氧化钠反应,证明一定含有甲酸乙酯;综上所述,一定含有甲酸乙酯,一定不含甲酸、乙酸,甲醇不能确定,可能含有. -
第23题:
填空题有一瓶溶液,可能含有Na+、K+、NH4+、Cl-、SO42-、CO32-中的一种或几种,实验步骤及现象如下: (1)取少许溶液进行焰色反应,火焰呈黄色,透过蓝色钴玻璃,观察不到浅紫色. (2)取少许溶液加入NaOH溶液并加热,不产生刺激性气体. (3)取少许溶液盛于试管中,加入Ba(NO3)2溶液,生成白色沉淀,再加入稀HNO3,白色沉淀全部溶解,继续加入HNO3至溶液呈酸性,并加热,然后加入AgNO3溶液,有白色沉淀生成. 根据以上实验,可以判断,这瓶溶液中肯定含有____;肯定不含有____.正确答案: Na+、Cl-、CO32-,NH4+、K+、SO42-解析:
(1)从焰色反应实验可断定这瓶溶液中肯定含有Na+,不含有K+;
(2)从加入少许NaOH溶液加热不产生刺激性气体,可断定这瓶溶液中不含有NH4+;
(3)加入Ba(OH)2溶液产生白色沉淀,沉淀可能是BaSO4,也可能是BaCO3,再加入稀硝酸,沉淀全部溶解,则可以断定溶液中不含有SO42-(因BaSO4不溶于稀硝酸),含有CO32-,加入稀HNO3后再加入AgNO3,生成不溶于稀HNO3的AgCl,可以断定溶液中含有Cl-.
