背景材料:下列实验操作正确的是()。A.将氢氧化钠固体放在滤纸上称量B.用10mL量筒量取8.58mL蒸馏水C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度。上面是某学校化学测试中的一道题。问题: (1)本题正确答案为(),分析学生可能出现的解题失误。 (2)分析其正确的解题思路。
题目
背景材料: 下列实验操作正确的是()。 A.将氢氧化钠固体放在滤纸上称量 B.用10mL量筒量取8.58mL蒸馏水 C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度。 上面是某学校化学测试中的一道题。 问题: (1)本题正确答案为(),分析学生可能出现的解题失误。 (2)分析其正确的解题思路。
相似考题
更多“背景材料: 下列实验操作正确的是()。 A.将氢氧化钠固体放在滤纸上称量 B.用10mL量筒量取8.58mL蒸馏水 C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度。 上面是某学校化学测试中的一道题。 问题: (1)本题正确答案为(),分析学生可能出现的解题失误。 (2)分析其正确的解题思路。”相关问题
-
第1题:
某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。
设NA表示阿伏加德罗常数的值,下列说法正确的是( )。
上面是某学校化学测试中的一道题,不少学生会错选为D。
回答下列问题:?
(1)本题正确答案为__________,解题思路为__________。
(2)分析学生解题错误可能是由哪些原因造成的。答案:解析:(1)AC。解题思路:在标准状况下,1mol任何气体所占体积都约为22.4L,因为决定它们体积大小的因素是气体分子问的距离.而不是分子本身体积的大小。对于混合气体,此结论也一定成立。(混合气体在标准状况下能自发反应。而导致反应前后气体分子数不等的除外,如N0和02。)所以在标准状况下1mol混合气体所占体积也是22.4L。反过来在标准状况下每22.4L气体所含分子数就一定是ⅣA。A项正确。
在标准状况下H2O并不是气态。而对于液体或固体物质来说,决定它们体积的因素是粒子本身的大小。不同粒子,其本身大小不同,体积也就不同。在标准状况下,1molH2O的体积不是22.4L。B项不正确。
物质的量和质量都是与温度、压强无关的基本物理量。也就是说.1mol物质在任何温度下,所含粒子数都仍为ⅣA(条件是该物质在此温度下能存在且不发生反应)。因此当+1价的氢被活泼金属还原成O价的氢时,只要有1molH2生成,就必然转移2mol电子,即转移电子总数为2Ⅳ (不管是标况还是常压)。C正确。
氮原子核外有7个电子,氮气分子核外有14个电子,则lmolN:含有的核外电子数就是14NA。D项不正确。
(2)错误分析:本题易错选D项,主要原因是部分同学考虑氮原子的核外电子排布时,只注意到最外层电子数为5而忽了内层电子数为2.从而得出错误结论。 -
第2题:
某化学老师在一次高二化学练习中设计了下列试题,并对部分学生的解题思路进行了分析。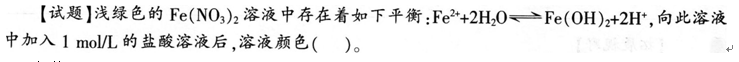
A.变黄
B.变浅
C.变深
D.不变
答题情况如下:选择A的占20%,选择8的占12%,选择C的占68%,选O的几乎没有。根据上述信息,回答下列问题:
(1)本题的正确答案是_________。
(2)如果你要讲解本题,请写出你的正确解题思路。
(3)请对学生答题错误形成的原因进行分析和诊断。答案:解析:
-
第3题:
某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。
【试题】下列叙述中,正确的是( )。
根据上述信息.回答下列问题:?
(1)本题的正确答案是____________。
(2)如果你要讲解本题,请写出你的正确解题思路。
(3)请对学生答题错误的原因进行分析和诊断。答案:解析:(1)C。
-
第4题:
某化学教师在一次测验中设计了下列测试题.并对学生的解题结果进行了统计和分析。
【试题】25℃时,将pH=6.0的盐酸用水稀释100倍,溶液pH是( )。
A.8
B.7
C.略小于7
D.略小于8 ,
【考试结果】统计学生答案如表l:
表1
根据以上信息,回答下列问题:
(1)本题的正确答案是什么
(2)请写出本题正确的解题思路。
(3)试对学生答题错误的原因进行分析和诊断。答案:解析:(1)C。 (2)正确的解题思路:因为酸度pH与浓度的函数关系图在pH=7的界限附近将呈现出渐近线趋势,但不会跨越pH=7这条界限,而变为碱性。pH=6.0的盐酸溶液加水稀释100倍,溶液无限接近中性,但溶液始终为酸性溶液,反映在pH上,即pH略小于7。
(3)学生选A的原因分析:pH=6.0时,c(H+)=10.6 mol/L。假设原溶液的体积为VL,将原溶液稀释100倍后,体积变为100V L则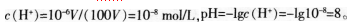
当溶液可能出现无限稀释的情况时,不能再用上述步骤进行计算。
无论盐酸溶液如何稀释,它依然是酸性溶液,无限稀释时也只能趋近于7,即略小于7。而不会等于7。错选B、D两项的原因是:对溶液pH计算方法掌握不清楚,不知道溶液稀释时pH的计算方法,同时不知道无限稀释时溶液的pH变化情况。 -
第5题:
某化学教师在一次化学测验中设计了下列试题.并对部分学生的考试结果进行了分析。
【试题】实验室里需用480?mL?0.1?mol/L的硫酸铜溶液,现选取500?mL容量瓶进行配制,以下操作正确的是( )。
A.称取7.68g硫酸铜,加入500?mL水?
B.称取12.0g胆矾配成500?mL溶液?
C.称取8.0g硫酸铜,加入500?mL水?
D.称取12.5g胆矾配成500?mL溶液?
【考试结果】部分学生按下述思路解题而错选答案A或B。
由于要配制480?mL?0.1?mol/L的硫酸铜溶液,因此需要溶质的质量为:(1)若溶质为硫酸?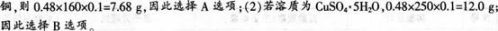
根据上述信息.回答下列问题:?
(1)本题的正确答案是_________。
(2)如果你要讲解本题,请写出你的正确解题思路。
(3)请对学生答题错误形成的原因进行分析和诊断。答案:解析:(1)D。
(2)解题思路:要配制500mL0.1mol/L的CuS04溶液需CuSO40.05mol即胆矾:0.05mol×250g mol-1=12.5g,CuSO4为89,所需溶液为500mL,而不是加水的体积为500mL,故A、B、C都不对。
(3)错误原因:①没有注意容量瓶的规格和特点。由于容量瓶为容量为500mL,且容量瓶只有一个刻度(标线),因此只能用该仪器配制500mL的溶液;②配制溶液时,所得的体积应该是溶液的体积.而不是加入的水的体积. -
第6题:
某化学教师为了检测学生对“金属活动性”知识的掌握程度.设置了下列试题.并对学生的答题结果进行统计与分析。
【试题】一位同学为了验证锌、银、铜三种金属的活动性顺序,设计了五个实验:①将Zn、Cu分别放入稀盐酸中;②将Ag放入Cu(N03)2溶液中;③将Cu放入AgN03溶液中;④将Cu放入ZnS04溶液中;⑤将Zn放入AgN03溶液中。
下列实验组合不能验证锌、银、铜三种金属活动性顺序的是( )。
A.①②
B.①③
C.②④
D.①⑤
【考试结果】有32.5%的同学选择了A或B。试根据上述信息.回答下列问题:
(1)本题正确答案是什么?
(2)试对学生解题错误的可能原因进行分析和诊断。
(3)如果你要讲评本题.你教给学生的正确的解题思路是什么?答案:解析:(1)D。
(2)错解分析:对金属与盐酸的反应不清楚,不能准确地判断金属是否能与盐酸反应放出氢气:未对实验的组合做出正确的判断。
(3)解题思路:为了确定金属的活动性顺序,常利用活动性居中的金属进行判断。①能证明
锌比铜活泼;②③能证明铜比银活泼;④能证明锌比铜活泼;⑤能证明锌比银活泼;综上可知①②、①③、②④能验证锌、铜、银三种金属的活动性顺序。 -
第7题:
某学生做完实验后,采用以下方法洗涤所用仪器: ① 用稀硝酸清洗做过银镜反应的试管; ② 用酒精清洗做过碘升华的烧杯; ③ 用浓盐酸清洗做过高锰酸钾分解实验的试管; ④ 用盐酸清洗长期存放过三氯化铁的试剂瓶; ⑤ 用氢氧化钠溶液清洗盛过苯酚的试管。 其中操作正确的是()。
- A、①③④⑤
- B、①②⑤
- C、①②③
- D、全部正确
正确答案:D -
第8题:
背景材料: 张老师在化学测验中设计了以下题目:实验室里需用480mL0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是()。 A.称取7.68g硫酸铜,加入500mL水 B.称取12.0g胆矾配成500mL溶液 C.称取8.0g硫酸铜,加入500mL水 D.称取12.5g胆矾配成500mL溶液 不少同学选择A或B选项。 问题: 回答下列问题: (1)分析学生出现解题失误的原因。 (2)本题正确答案为(),分析其正确的解题思路。
正确答案: (1)由于要配置480mL0.1mol/L的硫酸铜溶液,因此需要溶质的质量为:①若溶质为硫酸铜,则0.48×160×0.1=7.68g,因此选择A选项;②若溶质为CuSO4·5H2O,0.48×250×0.1=12.0g;因此选择B选项。错误原因:①没有注意容量瓶的规格和特点。由于容量瓶为容量500mL,且容量瓶只有一个刻度(标线),因此只能用该仪器配制500mL的溶液;②配制溶液时,所得的体积应该是溶液的体积,而不是加入的水的体积。
(2)本题的正确答案是D。解题思路:要配制500mLO.lmol/L的CuSO4溶液需CuSO40.05mol即胆矾:0.05mol×250g/mol-1=12.5g,CuSO4为8g,所需溶液为500mL,而不是加水的体积为500mL,故A、B、C都不对。 -
第9题:
配制500mL0.1mol/L的盐酸溶液,需量取4.2mL浓盐酸,下列哪种量取仪器的操作是正确的()。
- A、用滴定管取;
- B、用量筒取;
- C、用移液管取;
- D、用容量瓶取。
正确答案:C -
第10题:
问答题下列变化,必须加入还原剂才能实现的是()。 A.NH4+-NH3 B.C-CO2 C.SO2-S D.Cl2-Cl- 上面是某学校化学测试中的一道题,不少学生会出现错选。 回答下列问题: (1)本题正确答案是什么? (2)分析学生解题错误可能是由哪些原因造成的? (3)如果你是教师,你教给学生的正确解题思路是什么?正确答案: (1)C。
(2)误答原因:①误答A项,原因是不会判断元素的化合价。②误答B项,原因是思维混乱(或将关系记反了)。③误答D项,没有考虑到Cl2+H2O=HCl+HClO反应中,Cl2既是氧化剂又是还原剂。
(3)解题思路:A项中各元素化合价未变化,不是氧化还原反应。B项中碳元素从零价升高到正二价,被氧化了,需加入氧化剂。C项中硫元素从正四价降到零价,被还原了,需加入还原剂。D项中氯元素从零价降到负一价,被还原了,但Cl2+H2O=HCl+HClO反应中,Cl2既是氧化剂又是还原剂,加入的水既不是氧化剂也不是还原剂。解析: 暂无解析 -
第11题:
问答题某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。 【试题】在一定温度下,将少量的生石灰放入一定量的饱和石灰水中,搅拌并冷却到原来的温度,下列说法正确的是()。 A.溶剂的质量不变 B.溶液中溶质的质量分数不变 C.溶质的质量增加 D.溶液中溶质的质量分数增加 【考试结果】 部分学生答案选A或C。试根据上述考试结果回答下列问题: (1)本题正确答案为__________。 (2)试对学生解题错误的原因进行分析和诊断。 (3)如果你要讲评本题,你教给学生的正确的解题思路是什么?正确答案: (1)B。
(2)错解原因:生石灰放入水中与水发生化学反应生成氢氧化钙,但原来溶液是饱和石灰水,所以生成的氢氧化钙不溶,这一点学生往往能考虑到。对原溶液由于水参加化学反应而质量减少,导致溶液中一部分溶质氢氧化钙也减少认识不到。
(3)解题思路:生石灰放入水中与水发生化学反应生成氢氧化钙,但原来溶液是饱和石灰水,所以生成的氢氧化钙不溶:原溶液由于水参加化学反应,因此溶剂质量减少,因为原溶液是饱和溶液,所以原溶液中的部分溶质会析出,溶质质量减少,但由于仍然是饱和溶液,并且温度没变,所以溶液中溶质的质量分数不变。解析: 暂无解析 -
第12题:
问答题某教师在考试中设计了下列试题,部分学生的考试结果如下:【试题】已知:。某种混合气体中,可能含有N2,HCl,CO,将混合气体依次通过NaHCO3溶液和灼热的CuO,气体体积无变化,但有红色物质生成,再通过NaOH溶液,气体体积明显减少;将燃着的木条伸入盛有气体的集气瓶中,木条熄灭(假设每步反应都是完全的)。则下列说法正确的是()。A.一定有CO和HCl,肯定无N2B.一定有N2和CO,可能有HClC.一定有CO和HCl,可能有ND.一定有N2和CO,肯定无HCl【考试结果】部分学生错选答案为A或C。试根据上述考试结果回答下列问题:(1)本题正确答案为_______。(2)本题的解题思路是____________________________。(3)分析学生解题错误可能是由哪些原因造成的。正确答案: (1)B。
(2)解题思路:通过灼热的CuO,有红色物质生成,说明存在CO2,生成了CO2;再通过NaOH溶液,气体体积明显减少,说明CO2被吸收,最后使木条熄灭的是N2。根据题干所给方程式,通过NaHCO溶液,气体体积无变化,无法断定是否含有HCl。
(3)错解原因:学生误认为和NaOH反应的CO2一定是NaHCO3和HCl产生的,未想到CO和CuO在高温条件下生成铜的同时,也会产生CO2,所以并不能根据产生了CO2,就能确定原来混合气体中一定含有HCl,错选A;还有同学因为木条熄灭认为是存在CO2,未考虑前面在NaOH中已经把CO全部都吸收了,所以使木条熄灭的是N2。解析: 暂无解析 -
第13题:
某化学老师在一次化学测验中设计了下列试题.并对部分学生的解题结果进行了统计和分析。
【试题】利用图6所示装置进行下列实验,能得出相应实验结论的是( )。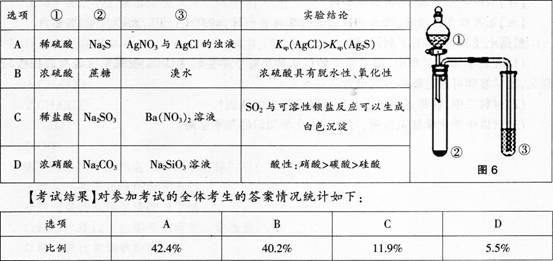
试根据上述信息,回答下列问题:
(1)本题正确的选项是什么
(2)请分析和诊断各个选项解答的错误原因。
(3)如果你要讲评本题,你教给学生的正确解题思路是什么答案:解析:(1)B。 (2)对物质之间发生的反应不清楚,误选A、C。对物质的性质不清楚,误选D。
-
第14题:
某化学教师在一次化学测验中设计了下列试题.并对部分学生的考试结果进行了统计和分析。
【试题】有关如图所示化合物的说法正确的是( )。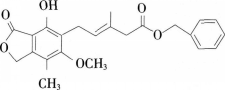

根据上述信息,回答下列问题:?
(1)本题的正确答案是__________。
(2)如果你要讲解本题,请写出你的正确解题思路。
(3)请对学生答题错误的原因进行分析和诊断。答案:解析:(1)B。
-
第15题:
某化学教师在一次化学测验中设计了下列试题,并对部分学生的解题结果进行了统计和分析。
【试题】在100 mL某硝酸和硫酸的混合溶液中,硝酸的浓度为0.4 mol·L-1,硫酸的浓度为0.1 mol·L-1,向其中加入1.92g铜片,微热使其充分反映,最终溶液中Cu2+的物质的量浓度为( )
(溶液体积的变化忽略不计,Cu的相对原子质量为64)
A.0.15 mol·L-1
B.0.225 mol·L-1
C.0.3 mol·L-1
D.0.6 mol·L-1
【考试结果】有54.6%的学生错选答案A。
试根据上述信息,回答下列问题:
(1)本题正确的答案是:______。讲评本题时,你教给学生的正确解题思路是______。
(2)试对学生错选答案A的原因进行诊断和分析。答案:解析:(1)B。正确解题思路:首先写出金属铜在混合溶液中发生反应的离子方程式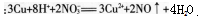 ,根据相关数据计算可以得到溶液中N03-物质的量是0.04mol,H+物质的量是0.06mol,加入铜片物质的量是0.03mol。根据离子方程式进行比较可得到N03-和铜均过量,H+完全反应,那么参加反应的铜的物质的量是
,根据相关数据计算可以得到溶液中N03-物质的量是0.04mol,H+物质的量是0.06mol,加入铜片物质的量是0.03mol。根据离子方程式进行比较可得到N03-和铜均过量,H+完全反应,那么参加反应的铜的物质的量是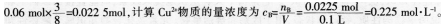 (2)很多同学错选A,是因为学生掌握知识是机械的、孤立的,仅考虑到按照铜与稀硝酸反应方程式
(2)很多同学错选A,是因为学生掌握知识是机械的、孤立的,仅考虑到按照铜与稀硝酸反应方程式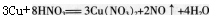 进行计算,由铜片物质的量是0.03mol,硝酸物质的量是0.04mol,就错误地认为参加反应的铜的物质的量是0.015mol,从而计算得到Cu2+物质的量浓度为0.15mol·L-1,而忽略了混合溶液中的硫酸也可以提供H+。
进行计算,由铜片物质的量是0.03mol,硝酸物质的量是0.04mol,就错误地认为参加反应的铜的物质的量是0.015mol,从而计算得到Cu2+物质的量浓度为0.15mol·L-1,而忽略了混合溶液中的硫酸也可以提供H+。 -
第16题:
某化学老师在一次化学测验中设计了下列试题,并对学生的解题结果进行了统计分析。?
蒸发1?tool?Br2(1)需吸收30?kJ能量其他相关数据如表1。?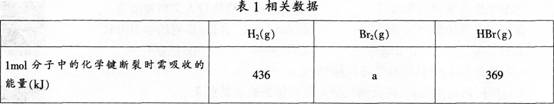
则表中a为( )。?
A.404
B.260
C.230
D.200
【考试结果】有78.3%的同学按下述思路解题而错选A。?
(1)本题正确答案是________(3分),正确解题思路是什么?(6分)
(2)试对学生解题错误形成的原因进行分析。(6分)答案:解析:(1)正确的答案是D。?
正确解题思路:
(2)学生产生错误的原因:学生没有正确理解并掌握△H的计算方法.“△H/=反应物的键能总和一生成物的键能总和=生成物的总能量(焓)一反应物的总能量(焓)”,材料中给出的数据为键能,而不是焓。学生掌握知识是机械的、孤立的,仅知道△H=生成物的总能量(焓)一反应物的总能量(焓),但是却没有正确理解材料中直接给出的是键能而不是焓,没有将键能跟焓的概念区分开,在碰到题目的时候生搬硬套.因此直接得出错误结论。? -
第17题:
某化学教师在一次化学测验中设计了下列试题.并对部分学生的解题结果进行了统计
和分析
【试题】重水(D20)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+)。下列关于pD叙述正确的是
【考试结果】全体考生的答题情况统计如下: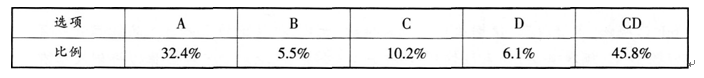
根据上述信息。回答下列问题:
(1)本题的正确答案是什么?(4分)如果你要讲评本题,你教给学生的正确解题思路是什么?(6分)
(2)试对学生解题错误形成的原因进行分析和诊断。(5分)答案:解析: (3)产生错误的原因:选A选项的同学没有理解pH、pD的意义,将常温下中性溶液的pH与pD混淆;选B选项的同学没有注意到重水的离子积与水的不同。
(3)产生错误的原因:选A选项的同学没有理解pH、pD的意义,将常温下中性溶液的pH与pD混淆;选B选项的同学没有注意到重水的离子积与水的不同。 -
第18题:
某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计?
和分析。把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入b?mol烧碱并加热,刚好把NH3全部赶出。另一份需消耗c?mol?BaCl2,沉淀反应刚好完全,原溶液中硝酸根离子的物质的量浓度为( )。
上面是某学校化学测试中的一道题.不少学生会错选A项。
回答下列问题:?
(I)本题正确答案是什么?
(2)分析学生可能出现的解题错误原因。
(3)如果你要测评本题,你教给学生的正确解题思路得什么?答案:解析:(1)D。
-
第19题:
背景材料: 在体积为VL的密闭容器中加入amolNO和bmolO2,反应后容器内氮原子数和氧原子数之比为()。 A.a/b B.a/2b C.a/(a+2b) D.a/2(a+b) 上面是某学校化学测试中的一道题。 问题: (1)本题正确答案为(),分析学生可能出现的解题失误。 (2)分析其正确的解题思路。
正确答案: (1)正确答案为C。学生可能会出现思维性错误。上述解题失误是由于学生受到了心理干扰,先人为主,策略性错误。由于计算因素的心理干扰,同学可能先考虑过量问题,再计算两种原子数之比。
(2)思路:质量守恒定律,反应前后原子的个数与种类不变,直接按反应前两种原子数目计算,由原子的物质的量之比等于原子个数之比可得答案C。 -
第20题:
下列变化,必须加入还原剂才能实现的是()。 A.NH4+-NH3 B.C-CO2 C.SO2-S D.Cl2-Cl- 上面是某学校化学测试中的一道题,不少学生会出现错选。 回答下列问题: (1)本题正确答案是什么? (2)分析学生解题错误可能是由哪些原因造成的? (3)如果你是教师,你教给学生的正确解题思路是什么?
正确答案: (1)C。
(2)误答原因:①误答A项,原因是不会判断元素的化合价。②误答B项,原因是思维混乱(或将关系记反了)。③误答D项,没有考虑到Cl2+H2O=HCl+HClO反应中,Cl2既是氧化剂又是还原剂。
(3)解题思路:A项中各元素化合价未变化,不是氧化还原反应。B项中碳元素从零价升高到正二价,被氧化了,需加入氧化剂。C项中硫元素从正四价降到零价,被还原了,需加入还原剂。D项中氯元素从零价降到负一价,被还原了,但Cl2+H2O=HCl+HClO反应中,Cl2既是氧化剂又是还原剂,加入的水既不是氧化剂也不是还原剂。 -
第21题:
问答题某教师在一次阶段测验中,设计了如下试题考查学生。集气瓶中盛有氮气和氧气的混合气体(体积比为4:1),采用燃烧法除去氧气而得到较纯净的氮气时,最好采用的物质是()。A.铁B.红磷C.木炭D.硫黄请回答下列问题:(1)该题目的正确答案是________,解题思路是________。(2)试分析造成学生解题错误的可能的原因。正确答案: (1)B。
解题思路:木炭和硫黄都能在氧气和空气中燃烧,燃烧后的产物分别是二氧化碳和二氧化硫,两者都是气体,会在除去氧气的同时,又引入其他气体,因此排除C、D两项。红磷也可以在氧气或空气或氧气与其他气体的混合气体中燃烧,而且生成固体五氧化二磷,符合题意。铁只能在纯净的氧气中燃烧,在氮气和氧气的混合气体中无法点燃。故本题选B。
(2)本题很多学生容易错选A,因为除去集气瓶中的某种气体的一个前提是某物质与该气体能反应且生成物是固体,而铁与氧气反应生成物是四氧化三铁,是一种黑色固体,从理论上可行,但却忽略了铁只能在纯净的氧气中燃烧,在氮气和氧气的混合气体中无法点燃的情况。这可能是由于学生基础知识掌握得还不够扎实,容易忽略一些关键性的细节,导致解题的失败。解析: 暂无解析 -
第22题:
问答题某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。 【试题】现有Cu、Cu(OH)2、Fe2O3、BaCO3、AgNO3溶液、盐酸,若各取少量两两混合,可以发生的化学反应共有________个,其中有________个反应可以生成水,有________个反应属于置换反应。 【考试结果】部分学生错解答案为可发生的化学反应有4个,其中有2个反应可以生成水,有1个反应属于置换反应。 试根据上述考试结果回答下列问题: (1)本题正确答案为____。 (2)如果你要讲评本题,你教给学生的正确的解题思路是什么? (3)分析学生解题错误可能是由哪些原因造成的。 (1)5;3;1。正确答案: (2)解题思路:Cu和AgNO可发生置换反应。根据复分解反应的条件知Cu(OH)2、Fe2O3、BaCO3、AgNO3溶液都能和盐酸发生复分解反应。因Cu(OH)2和BaCO都是难溶于水的物质,Cu(OH)、BaCO3、AgNO3溶液三者之间不能反应。
(3)错解原因:误认为碳酸钡不溶于水,不能与盐酸发生复分解反应。解析: 暂无解析 -
第23题:
问答题背景材料: 在体积为VL的密闭容器中加入amolNO和bmolO2,反应后容器内氮原子数和氧原子数之比为()。 A.a/b B.a/2b C.a/(a+2b) D.a/2(a+b) 上面是某学校化学测试中的一道题。 问题: (1)本题正确答案为(),分析学生可能出现的解题失误。 (2)分析其正确的解题思路。正确答案: (1)正确答案为C。学生可能会出现思维性错误。上述解题失误是由于学生受到了心理干扰,先人为主,策略性错误。由于计算因素的心理干扰,同学可能先考虑过量问题,再计算两种原子数之比。
(2)思路:质量守恒定律,反应前后原子的个数与种类不变,直接按反应前两种原子数目计算,由原子的物质的量之比等于原子个数之比可得答案C。解析: 暂无解析
