短周期元素X、Y的原子序数相差6,下列有关判断错误的是()。A、X与Y可能位于同一周期或相邻周期B、X与Y可能位于同一主族或相邻主族C、X与Y可能形成离子化合物XYD、X与Y可能形成原子化合物XY2
题目
短周期元素X、Y的原子序数相差6,下列有关判断错误的是()。
- A、X与Y可能位于同一周期或相邻周期
- B、X与Y可能位于同一主族或相邻主族
- C、X与Y可能形成离子化合物XY
- D、X与Y可能形成原子化合物XY2
相似考题
更多“短周期元素X、Y的原子序数相差6,下列有关判断错误的是()。A、X与Y可能位于同一周期或相邻周期B、X与Y可能位于同一主族或相邻主族C、X与Y可能形成离子化合物XYD、X与Y可能形成原子化合物XY2”相关问题
-
第1题:
X、Y、Z是周期表中3种相邻的元素,X和Y同周期,Y和Z同主族.这3种元素原子的最外电子层中电子数的总和是17,核内质子数的总和是31,则X、Y.Z3种元素是下列各组中的( )A.N、O、S
B.O、S、P
C.O、F、Cl
D.C、Si、P答案:A解析: -
第2题:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )。
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的简单气态氢化物的热稳定性比W强答案:D解析:由X、Y、Z、W的原子序数依次增大,x原子的最外层电子数是其内层电子数的2倍,可知X是C元素;Y是地壳中含量最高的元素,因此Y是0元素;Z2+和Y2-一具有相同的电子层结构,因此Z是Mg元素;W和X位于同主族,因此W是Si元素。A项,原子半径顺序应该是r(Z)>r(W)>r(X)>r(Y),A项错误;B项,Y与Z形成的化合物是M90,化学键是离子键,Y与W形成的化合物是Si02,化学键是共价键,B项错误;C项,同主族元素从上到下最高价氧化物对应的氧化物的酸性依次减弱.C项错误:D项,同周期元素对应的气态氢化物的稳定性从左到右依次增强,同主族的元素气态氢化物的稳定性从上到下依次减弱.故Y的简单气态氢化物的热稳定性比W的强.故D正确。 -
第3题:
X、Y、z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )。 答案:A解析:X、Y、Z均为短周期元素,Y+、Z-具有相同的电子层结构,说明Y位于2的下一周期,同时X、Y处于同一周期,X、Z的最低价离子分别为X2-、Z-,说明X是
答案:A解析:X、Y、Z均为短周期元素,Y+、Z-具有相同的电子层结构,说明Y位于2的下一周期,同时X、Y处于同一周期,X、Z的最低价离子分别为X2-、Z-,说明X是
-
第4题:
短周期主族的非金属元素X、Y、Z在周期表中的位置如图所示,下列有关说法一定正确的是( )。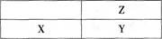 A、气态氢化物的稳定性:Z>Y>X
A、气态氢化物的稳定性:Z>Y>X
B、第一电离能:Z>Y>X
C、含氧酸的酸性:Z>Y>X
D、元素的最高化合价:Z=Y>X答案:A解析:同周期元素,从左到右,非金属性逐渐增强;同主族元素,从上到下,非金属性逐渐减弱。非金属性越强,气态氢化物越稳定,A项正确。若X是P,Y是S,Z是O,则第一电离能Z>X>Y,B项错误。若X是S,Y是Cl,Z是F,F没有含氧酸,F没有正化合价,C、D项错误。故本题选A。 -
第5题:
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件: ①元素周期表中,Z与Y相邻,Z与W也相邻; ②Y、Z和W三种元素的原子最外层电子数之和为17。 请填空: (1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):(),理由是()。 (2)Y是(),Z是(),W是()。 (3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式()。
正确答案:否;若同一周期左右相邻,则X-1+X+X+1=17,X为小数;O;N;S;名称为:硫酸铵,化学式为:(NH4)2SO4 -
第6题:
X元素的最高正价和负价的绝对值之差为6,Y元素原子次外层与X元素原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是()
- A、MgF2
- B、MgCl2
- C、CaCl2
- D、CaBr2
正确答案:C -
第7题:
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有哪些?
正确答案:1s2、2s2、3s2、4s2、3d64s2、3d94s2、3d104s2 -
第8题:
X、Y两元素的质子数之和为22,X的原子核外电子数比Y少6个,下列说法中不正确的是( )
- A、Y的单质是金属晶体
- B、X的单质固态时为分子晶体
- C、X与碳形成的化合物为分子晶体
- D、X与Y形成的化合物固态时为分子晶体
正确答案:A,D -
第9题:
元素X和Y在元素周期素中处于相邻周期,两种元素原子的质子数之和为21,Y元素原子的核外电子数比X元素原子的核外电子数多5。则下列叙述不正确的是()
- A、X和Y两元素形成的化合物在熔融状态下电解可以得到两元素的单质
- B、Y元素的单质不能和金属氧化物反应
- C、X和Y构成一种阴离子,这种阴离子与过量H+反应可以转变为Y元素阳离子
- D、X元素的一种单质能有效地吸收太阳光线中的紫外线
正确答案:B -
第10题:
单选题X和Y均为短周期元素,X元素的阳离子和Y元素的阴离子具有相同的核外电子层结构,下列叙述正确的是( ).A原子序数X<Y
B原子半径X>Y
C原子的电子层数X<Y
D原子最外层电子数X>Y
正确答案: C解析:
X元素的阳离子和Y元素的阴离子具有相同的核外电子排布,则X元素处于Y元素的下一周期,X为金属元素,Y为非金属元素.A项,X在Y的下一周期,则原子序数X>Y;B项,X在Y的下一周期,X的电子层多,则原子半径为X>Y;C项,X在Y的下一周期,X的电子层多,则电子层数为X>Y;D项,无法判断最外层电子数的多少. -
第11题:
单选题X元素的最高正价和负价的绝对值之差为6,Y元素原子次外层与X元素原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是()AMgF2
BMgCl2
CCaCl2
DCaBr2
正确答案: A解析: X元素的最高正价和负价的绝对值之差为6,只有卤素可以满足,且次外层为8个电子,则该卤素为Cl,与Cl-具有相同的电子排布的Y元素只能是K+或Ca2+,故C正确。 -
第12题:
问答题已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:若X原子的外围电子层排布为3d104s2,Y可能是什么元素?(写元素符号)正确答案: F、Cl解析: 暂无解析 -
第13题:
元素X、Y、Z都位于短周期,它们的原子序数按X、Y、Z的顺序依次增大。X和Z位于同一主族,Y和Z位于同一周期。Y的单质与2的单质相互作用,生成离子化合物Y2Z。则X原子的结构示意图为__________。Y2Z的电子式为__________。答案:解析: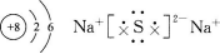
-
第14题:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和2-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )。.A.原子的最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X>Y>z-
D.原子序数:X>Y>Z答案:D解析:由于x、Y、z均为短周期元素,Y+与z一的电子层结构相同,所以两种元素位于相邻周期,则Y是Na,Z是F,则X是S。原子最外层电子数F>S>Na,A项错误;单质沸点:Na>S>F:,B项错误;离子半径:S2->F>Na十,C项错误;原子序数:S>Na>F,D项正确。故选D。 -
第15题:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )。A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强答案:D解析:【知识点】元素周期表
【解析】由题意可知,X为碳,Y为氧,Z为镁,W为硅,则原子半径镁大于硅,A项错误;氧化镁为离子键,二氧化硅为共价键,B项错误;碳酸的酸性大于硅酸,C项错误;水的热稳定性大于硅烷.D项正确。故本题选D。 -
第16题:
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的
D.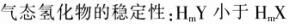 答案:C解析:由题中条件得X、Y同周期,且电负性X>Y,因为同一周期电负性逐渐增加,则X的非金属性强于Y的,故X最高价含氧酸的酸性强于Y的。故选C。
答案:C解析:由题中条件得X、Y同周期,且电负性X>Y,因为同一周期电负性逐渐增加,则X的非金属性强于Y的,故X最高价含氧酸的酸性强于Y的。故选C。 -
第17题:
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:若X原子的外围电子层排布为3d104s2,Y可能是什么元素?(写元素符号)
正确答案:F、Cl -
第18题:
合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:Y与Z形成的化合物的分子式是什么,该化合物中化学键的种类会是什么?
正确答案:C.S2
极性键 -
第19题:
X.Y是短周期元素,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数为()
- A、n+11
- B、n-11
- C、n-6
- D、n-5
- E、n+5
正确答案:A,D -
第20题:
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题: (1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:()、()、()、()等。 (2)若X原子的外围电子层排布为3d104s2,Y可能是()元素或()元素(写元素符号)。 (3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:()、()、()、()、()、()、()。
正确答案:CO2;SO2;SiO2;CS2;F;Cl;1s2;2s2;3s2;4s2;3d64s2;3d94s2;3d104s2 -
第21题:
单选题X、Y为同周期元素,如果X的原子半径大于Y,则下列判断不正确的是( ).A如X、Y均为金属元素,则X的金属性强于Y
B如X、Y均为金属元素,则X的阳离子氧化性比Y形成的阳离子强
C如X、Y均为非金属元素,则Y的气态氢化物比X的稳定
D如X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X
正确答案: A解析:
A项,若X、Y均为金属元素,同周期从左到右,元素的金属性从强到弱;B项,若X、Y均为金属元素,同周期从左到右,离子的氧化性从弱到强;C项,若X、Y均为非金属元素,从左到右,元素的非金属性从弱到强,气态氢化物越来越稳定;D项,若X、Y均为非金属元素,从左到右,最高价氧化物对应的水化物酸性越来越强. -
第22题:
单选题短周期元素X、Y的原子序数相差6,下列有关判断错误的是()。AX与Y可能位于同一周期或相邻周期
BX与Y可能位于同一主族或相邻主族
CX与Y可能形成离子化合物XY
DX与Y可能形成原子化合物XY2
正确答案: B解析: A项,例如Na与Cl和Na与N,A项正确;B项,同族元素相差2、8、10、18,B项错误:C项,例如Na与Cl,C正确;D项,如SiO2,D项正确;故选B。 -
第23题:
填空题已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题: (1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:()、()、()、()等。 (2)若X原子的外围电子层排布为3d104s2,Y可能是()元素或()元素(写元素符号)。 (3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:()、()、()、()、()、()、()。正确答案: CO2,SO2,SiO2,CS2,F,Cl,1s2,2s2,3s2,4s2,3d64s2,3d94s2,3d104s2解析: 暂无解析
