测定水的总硬度,结果是以什么化合物计算()A、MgCO3B、SiO2C、Na2SiO3D、CaCO3
题目
测定水的总硬度,结果是以什么化合物计算()
- A、MgCO3
- B、SiO2
- C、Na2SiO3
- D、CaCO3
相似考题
更多“测定水的总硬度,结果是以什么化合物计算()A、MgCO3B、SiO2C、Na2SiO3D、CaCO3”相关问题
-
第1题:
测定总硬度时,溶液终点颜色为蓝色,这种蓝色化合物是( )。A.MIn
B.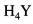
C.MY
D.In答案:B解析: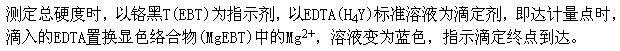
-
第2题:
测定水的总硬度和钙硬度时都是用EDTA容量法,只是所选指示剂不同
正确答案:错误 -
第3题:
在水的总硬度测定时,已知EDTA浓度为0.01003mol/L, 消耗EDTA体积 5.61mL,计算水的总硬度时, 有效数字应取()位?
- A、5
- B、4
- C、3
- D、2
正确答案:C -
第4题:
处理线使用的软水的总硬度为4~6(CaCO3)。
正确答案:正确 -
第5题:
怎样测定水的总硬度?
正确答案:采用配位滴定,以EDTA为滴定剂,铬黑T为指示剂。用氨系列缓冲溶液,控制pH=10.0加入指示剂进行滴定,溶液由紫红色变为蓝色即为终点。 -
第6题:
水的总硬度是以CaCO3。
正确答案:正确 -
第7题:
水的硬度是指水中Ca2+、Mg2+浓度的总量,硬度的单位有()(以CaCO3计)。
正确答案:mmol·L-1、mg·L-1 -
第8题:
测定水的总硬度,吸取水样50.0ml,以铬黑T为指示剂,用0.0105mol/LEDTA-2Na标准溶液滴定,耗去4.05ml,可得此样的总硬度为()(以CaCO3计,换算系数100.09)。
- A、85.1mg/L
- B、8.51mg/L
- C、851.3mg/L
- D、0.85mg/L
正确答案:D -
第9题:
含有重碳酸硬度的给水进入锅内后,一部分受热分解成(),变成固相粒,而粘附在金属受热面上结成水垢。
- A、CaCO3和MgCO3
- B、MgCO3
- C、CaCO3和Mg(OH)2
- D、MgCO3和Ca (OH)2
正确答案:C -
第10题:
吸取100ml水样,以铬黑T为指示剂,pH=10,测定总硬度消耗0.01020mol•L-1EDTA16.72ml。计算水样的总硬度。(以CaCO3计)
正确答案:0.01020×16.72×1000=170.5 mg•L-1 -
第11题:
问答题某地区水质分析结果如下:〔Ca2+〕=46.0mg∕L,〔HCO3-〕=128.1mg∕L,〔Mg2+〕=8.5mg∕L,〔SO42-〕=72.0mg∕L,〔Na+〕=46.0mg∕L,〔Cl-〕=49.7mg∕L。试求①审核阴、阳离子含量是否合理;②水中的总硬度和总碱度;③判断该水属于何种水;④水中的碳酸盐硬度、非碳酸盐硬度、负硬度;⑤写出假想化合物的分子式,并计算其含量。正确答案:
①将每种离子的含量都换算成mmol∕L单位表示:
〔Ca2+〕=46.0∕20=2.3mmol∕L
〔Mg2+〕=8.5∕12=0.7mmol∕L
〔Na+〕=46.0∕23=2.0mmol∕L
阳离子含量为5.0mmol∕L;
〔HCO3-〕=128.1∕61=2.1mmol∕L
〔SO42-〕=72.0∕48=1.5mmol∕L
〔Cl-〕=49.7∕35.5=1.4mmol∕L阴离子含量为5.0mmol∕L。计算结果该水样中的阳离子和阴离子各为5.0mmol∕L,彼此相等,说明计算结果正确。
②水中的总硬度和总碱度分别为:
YD=〔Ca2+〕+〔Mg2+〕=2.3+0.7=3.0mmol∕L
JD=〔HCO3-〕=2.1mmol∕L
③由于该水样的总硬度YD大于总碱度JD,即Ca2++Mg2+>HCO3-,可知该水属于非碱性水。水中既有碳酸盐硬度,又有非碳酸盐硬度,无负硬度。又因〔Ca2+〕>〔HCO3-〕,可知该水为钙硬水,水中有钙的非碳酸盐硬度(即CaSO4),没有镁的碳酸盐硬度。
④水中的碳酸盐硬度、非碳酸盐硬度、负硬度分别为:
YDT=JD=3.0mmol∕L
YDFT=YD-JD=3.0-2.1=0.9mmol∕L
YDf=0
⑤阴、阳离子组合成各种假想化合物的组成、想化合物的分子式及其含量:
Ca2+先和HCO3-结合成2.1mmol∕L的Ca(HCO3)2,剩余的Ca2+和SO42-结合成2.3-2.1=0.2mmol∕L的CaSO4,Mg2+和剩余的SO42-结合成0.7mmol∕L的MgSO4,Na+和余下的SO42-结合成1.5-0.2-0.7=0.6mmol∕L的Na2SO4,余下的Na+和Cl-结合成0.6mmol∕L的NaCl。
①水中阴、阳离子含量合理;②水中的总硬度和总碱度分别为3.0mmol∕L和2.1mmol∕L;③该水属于非碱性水,且为钙硬水;④水中的碳酸盐硬度、非碳酸盐硬度、负硬度分别为3.0mmol∕L、0.9mmol∕L和0:⑤水中离子假想结合化合物为:
Ca(HCO3)2(碳酸氢钙)2.1mmol∕L
CaSO4(硫酸钙)0.2mmol∕L
MgSO4(硫酸镁)0.7mmol∕L
Na2SO4(硫酸钠)0.6mmol∕L
NaCl(氯化钠)0.6mmol∕L解析: 暂无解析 -
第12题:
单选题测定水的总硬度,结果是以什么化合物计算()AMgCO3
BSiO2
CNa2SiO3
DCaCO3
正确答案: A解析: 暂无解析 -
第13题:
溶于水中钙、镁盐类的总含量,以CaCO3(mg/L)表示,是指水的()
- A、硬度
- B、总固体
- C、矿物质含量
- D、硫酸盐含量
- E、溶解性物质的含量
正确答案:A -
第14题:
测定水的总硬度通常采用高猛酸钾滴定法。
正确答案:错误 -
第15题:
处理线使用的生活水的总硬度为200~250(CaCO3)。
正确答案:正确 -
第16题:
测定水中总硬度时,在配制的EDTA标准滴定溶液中,常加入少量Mg2+有何作用?它对测定结果有无影响?为什么?
正确答案:水的总硬度测定,在配制的EDTA标准溶液中,加入少量Mg2+对测定无影响,例如:Ca2+的水样中(Mg2+含量很少时)加入MgY2-,再加入铬黑T(EBT)指示剂以EDTA滴定,发生下述置换反应和滴定反应:
M.gY2-+Ca2+→CaY2-+Mg2+
M.g2++HIn2-→MgIn-+H+
C.a2++Y4-→CaY2-
终点时:MIn-+Y4-+H+→MgY2-+HIn2-
酒红色纯蓝色
这是由于KCaY>KMgY而KMg-EBT>KCa-EBT即Mg2+与EBT显色灵敏度高于Ca2+与EBT显色的灵敏度。这样可提高终点变色的敏锐性,并使终点误差变小。在这里,滴定前加入的EDTA-Mg和最后生成的EDTA-Mg的量是相等的,故加入的EDTA-Mg不影响滴定结果。 -
第17题:
什么叫非碳酸盐硬度?什么是水的总硬度?
正确答案: 由钙与镁的硫酸盐、硝酸盐及氯化物等形成的硬度称为非碳酸盐硬度,它不能用一般的煮沸法去除,故又称永久硬度。碳酸盐硬度和非碳酸盐硬度的总和,称为水的总硬度。 -
第18题:
测定总硬度时,吸取水样100ml,以铬黑T指示剂,调pH=10,用0.0100mol·L-1标准EDTA溶液滴定,用去3.00ml。计算水样的硬度。(以CaCO3计)
正确答案: 30.00mg·L--1 -
第19题:
测定水的总硬度通常采用EDTA-2Na法。
正确答案:正确 -
第20题:
某地区水质分析结果如下:〔Ca2+〕=46.0mg∕L,〔HCO3-〕=128.1mg∕L,〔Mg2+〕=8.5mg∕L,〔SO42-〕=72.0mg∕L,〔Na+〕=46.0mg∕L,〔Cl-〕=49.7mg∕L。试求①审核阴、阳离子含量是否合理;②水中的总硬度和总碱度;③判断该水属于何种水;④水中的碳酸盐硬度、非碳酸盐硬度、负硬度;⑤写出假想化合物的分子式,并计算其含量。
正确答案:
①将每种离子的含量都换算成mmol∕L单位表示:
〔Ca2+〕=46.0∕20=2.3mmol∕L
〔Mg2+〕=8.5∕12=0.7mmol∕L
〔Na+〕=46.0∕23=2.0mmol∕L
阳离子含量为5.0mmol∕L;
〔HCO3-〕=128.1∕61=2.1mmol∕L
〔SO42-〕=72.0∕48=1.5mmol∕L
〔Cl-〕=49.7∕35.5=1.4mmol∕L阴离子含量为5.0mmol∕L。计算结果该水样中的阳离子和阴离子各为5.0mmol∕L,彼此相等,说明计算结果正确。
②水中的总硬度和总碱度分别为:
YD=〔Ca2+〕+〔Mg2+〕=2.3+0.7=3.0mmol∕L
JD=〔HCO3-〕=2.1mmol∕L
③由于该水样的总硬度YD大于总碱度JD,即Ca2++Mg2+>HCO3-,可知该水属于非碱性水。水中既有碳酸盐硬度,又有非碳酸盐硬度,无负硬度。又因〔Ca2+〕>〔HCO3-〕,可知该水为钙硬水,水中有钙的非碳酸盐硬度(即CaSO4),没有镁的碳酸盐硬度。
④水中的碳酸盐硬度、非碳酸盐硬度、负硬度分别为:
YDT=JD=3.0mmol∕L
YDFT=YD-JD=3.0-2.1=0.9mmol∕L
YDf=0
⑤阴、阳离子组合成各种假想化合物的组成、想化合物的分子式及其含量:
Ca2+先和HCO3-结合成2.1mmol∕L的Ca(HCO3)2,剩余的Ca2+和SO42-结合成2.3-2.1=0.2mmol∕L的CaSO4,Mg2+和剩余的SO42-结合成0.7mmol∕L的MgSO4,Na+和余下的SO42-结合成1.5-0.2-0.7=0.6mmol∕L的Na2SO4,余下的Na+和Cl-结合成0.6mmol∕L的NaCl。
①水中阴、阳离子含量合理;②水中的总硬度和总碱度分别为3.0mmol∕L和2.1mmol∕L;③该水属于非碱性水,且为钙硬水;④水中的碳酸盐硬度、非碳酸盐硬度、负硬度分别为3.0mmol∕L、0.9mmol∕L和0:⑤水中离子假想结合化合物为:
Ca(HCO3)2(碳酸氢钙)2.1mmol∕L
CaSO4(硫酸钙)0.2mmol∕L
MgSO4(硫酸镁)0.7mmol∕L
Na2SO4(硫酸钠)0.6mmol∕L
NaCl(氯化钠)0.6mmol∕L -
第21题:
热力软化法就是将水加热到100℃或以上,在煮沸过程中,使水中的钙、镁、重碳酸盐转变为()沉淀去除。
- A、CaCO3和MgCO3
- B、CaCO3和Mg(OH)2
- C、Ca(OH)2和Mg(OH)2
- D、Ca(OH)2和MgCO3
正确答案:B -
第22题:
单选题关于水的硬度的叙述中,错误的是()。A水的硬度是反映水质的主要指标之一
B水的硬度是指水中Ca2+、Mg2+的总量
C水的硬度最通用的测定方法是EDTA滴定法
D测水的硬度时,以钙指示剂指示滴定终点
E水的硬度可用每升水中所含CaCO3的毫克数来表示
正确答案: C解析: 暂无解析 -
第23题:
问答题吸取100ml水样,以铬黑T为指示剂,pH=10,测定总硬度消耗0.01020mol•L-1EDTA16.72ml。计算水样的总硬度。(以CaCO3计)正确答案: 0.01020×16.72×1000=170.5 mg•L-1解析: 暂无解析
