下列叙述的周期表中同族元素的关系,不正确的是()A、最高正价必然相等B、最外层电子数不一定相等C、化学性质相似D、金属性自上而下增强E、以上叙述没有不正确的
题目
下列叙述的周期表中同族元素的关系,不正确的是()
- A、最高正价必然相等
- B、最外层电子数不一定相等
- C、化学性质相似
- D、金属性自上而下增强
- E、以上叙述没有不正确的
相似考题
参考答案和解析
更多“下列叙述的周期表中同族元素的关系,不正确的是()A、最高正价必然相等B、最外层电子数不一定相等C、化学性质相似D、金属性自上而下增强E、以上叙述没有不正确的”相关问题
-
第1题:
与元素的化学性质关系最密切的是( )
A.元素的相对原子质量 B.元素的核电核数
C.原子的核外电子数 D.原子的最外层电子数
D -
第2题:
a、b、c为短周期元素,a的M电子层有1个电子,b、c的最外层电子数都为电子层数的两倍,c的最高化合价为最低化合价绝对值的3倍。下列叙述错误的是( )。
A.e比b元素的非金属性强
B.a元素在自然界不存在游离态
C.a、b、c均存在两种或两种以上的氧化物
D.b、c分别与氢形成的化合物均为极性共价化合物答案:D解析:根据题意可以推断出a为Na,b为C,c为S。把硫酸加入碳酸钠溶液中.生成二氧化碳气体,说明硫酸的酸性比碳酸强,最高价含氧酸的酸性越强对应元素的非金属性越强,所以S的非金属性比C的非金属性强,A项正确;金属钠是非常活泼的金属,可以和空气中的水、氧气反应,所以金属钠在自然界中不能以游离态的形式存在,B项正确;Na的氧化物有氧化钠、过氧化钠,C的氧化物有一氧化碳、二氧化碳,S的氧化物有二氧化硫、三氧化硫,由此判断,C项正确;b与氢形成的化合物为甲烷,甲烷为非极性共价化合物,C与氢形成的化合物为硫化氢,硫化氢为极性共价化合物,D项错误。故本题选D。 -
第3题:
对于第二周期从左到右的主族元素,下列说法中不正确的是()
- A、原子半径逐渐减小
- B、电子层数逐渐增多
- C、最高正化合价逐渐增大
- D、元素的非金属性逐渐增强
正确答案:B -
第4题:
某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。下列叙述中哪一个不正确()?
- A、外层电子排布为3d54s1
- B、该元素为第四周期、VIB族元素铬
- C、+3价离子的外层电子排布式为3d24s1
- D、该元素的最高价氧化物的水合物为强酸
正确答案:C -
第5题:
在元素周期表中,同一周期元素,从左到右的递变规律是()。
- A、原子半径减小
- B、金属性增强
- C、非金属性增强
- D、最高正价相同
正确答案:A,C -
第6题:
氮族元素的最外层电子数为5,随着核电荷数的递增,得电子的能力逐渐减弱,非金属性逐渐增强。
正确答案:错误 -
第7题:
某短周期元素的最外层电子数比次外层电子数少3个,该元素气态氢化物中的化合价为()
- A、+5价
- B、-3价
- C、-2价
- D、+3价
正确答案:B -
第8题:
针对核电荷数为1~20的元素,有人说:“元素的最高正化合价数值与元素原子的最外层电子数相等”。这一说法是否适用于除稀有气体元素以外的所有元素?请举例说明。
正确答案:以上说法只适用于主族元素,不适用于过渡元素。如锰元素最外电子层上只有2个电子,而它的最高正化合价为+7价;铜元素最外电子层上只有1个电子,而铜的常见化合价却是+2价。 -
第9题:
某元素其原子最外层有2个电子,次外层有13个电子,问此元素在周期表中应属哪族?最高正价是多少?是金属还是非金属?
正确答案:应该属于ⅦB簇,最高正价+7,金属。 -
第10题:
多选题X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( ).AX的原子序数比Y的小
BX原子的最外层电子数比Y的多
CX的原子半径比Y的大
DX元素的最高正价比Y的小
正确答案: B,A解析:
具有氩原子相同电子层结构的阴离子是第三周期的非金属离子(S2-、Cl-)、阳离子是第四周期的ⅠA、ⅡA的金属离子(K+、Ca2+).由于阳离子的元素位于第四周期,其原子序数与原子半径都比Y元素的大,故最高正价较小. -
第11题:
单选题元素周期表中20号以前的元素,原子最外层的电子数等于次外层的电子数的有()。A1种
B2种
C3种
D4种
正确答案: B解析: 暂无解析 -
第12题:
单选题下列的叙述正确的是( ).A凡是原子最外层电子数少于4的一定是金属元素
B因为在元素周期表中,从左到右元素的非金属性增强,从上到下元素的非金属性减弱,所以除氢外,非金属元素都分布在周期表的右上部分
C电解水产生H2和O2,所以水是由H2和O2组成的
D氢气具有还原性,所以氢气还原氧化铜的反应是一个还原反应
正确答案: B解析:
A项,有少数元素最外层电子数少于4而不是金属元素,如B、He、H;C项,水是一种化合物,它的分子由2个氢原子和1个氧原子构成,并不是由氢分子和氧分子构成的;D项,还原反应和氧化反应总是同时发生的.平常说氧化反应或还原反应,只不过指反应中某一种反应物的变化而言,用氢气还原氧化铜,对氧化铜的变化来说是还原反应,但对氢气的变化来说则是氧化反应.所以氢气还原氧化铜的反应应称为氧化—还原反应. -
第13题:
某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。下列叙述中不正确的是( )。A.外层电子排布为3d54s1
B.该元素为第四周期、ⅥB族元素铬
C.+3价离子的外层电子排布式为3d24s1
D.该元素的最高价氧化物的水合物为强酸答案:C解析:根据题意,最高氧化数为+6的元素有VIA族和VIB族元素;而已知最外层只有一个电子,故只能是VIB族元素;在由已知中最后一个条件“原子半径是同族元素中最小的”,可确定该元素是VIB组中的Cr,Cr的电子排布式为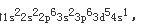
,可得出以下结论:
外层电子排布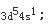
因为周期数等于电子层数,等于最高主量子数,即第四周期。他的最后一个电子填充在d亚层上,所以它是副族元素,其族数等于[(n-1)d+ns]电子层上的电子数,对Cr来讲为5+1=6,即ⅥB族元素;
因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为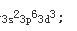
Cr的最高价氧化物CrO3,其水合物为H2CrO4或H2Cr2O7均为强酸。 -
第14题:
某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。 下列叙述中哪一个不正确?A.外层电子排布为3d54s1
B.该元素为第四周期、ⅥB族元素铬
C. +3价离子的外层电子排布式为3d2s1
D.该元素的最高价氧化物的水合物为强酸答案:C解析:解:本题涉及核外电子排布与周期表的问题,根据题意,最高氧化数为+6的元素有ⅥA族和ⅥB族元素;而最外层只有一个电子的条件就排除了ⅥA族元素;最后一个条件是原子半径为同族中最小,可确定该元素是ⅥB族中的铬。Cr的电子排布式为1s22s22p63s23p63d54s1, 所以得出以下结论。
A正确。外层电子排布为3d54s1。
B正确。因为周期数等于电子层数,等于最高主量子数,即第四周期。它的量后一个电子填充在d亚层上,所以它是副族元素,而副族元素的族数等于[(n-1)d+ns]层上的电子数,对 铬来讲为5+1 = 6,即ⅥB族元素。
C错误。因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为3s23p63d3。
D正确。Cr的最高氧化物CrO3,其水合物为H2CrO4或H2Cr2O7均为强酸。
所以答案应为C。 -
第15题:
周期表中,主组元素所在族序数等于最外层电子数。
正确答案:正确 -
第16题:
下列有关同位素的说明中,正确的是()
- A、质量数相等,原子序数不同,化学性质相似
- B、质量数和原子序数都相等,化学性质不同
- C、质量数不相等,原子序数相等,化学性质相似
- D、质量数不相等,原子序数相等,化学性质不同
正确答案:C -
第17题:
元素周期表与原子结构关系()。
- A、原子序数=核电荷数
- B、周期序数=电子层数
- C、主族序数=最外层电子数
- D、族元素最外层电子数为8
正确答案:A,B,C -
第18题:
周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是()。
- A、电子数
- B、最外层电子数
- C、电子层数
- D、次外层电子数
正确答案:A,D -
第19题:
元素周期表中20号以前的元素,原子最外层的电子数等于次外层的电子数的有()。
- A、1种
- B、2种
- C、3种
- D、4种
正确答案:B -
第20题:
某些元素原子最外层有两个电子,次外层有13个电子,这些元素在周期表中应属于()族,最高氧化数是(),是()(金/非金)属。
正确答案:ⅦB;+7;金 -
第21题:
某元素的最高正价为+6,最外层电子数为1,原子半径是同族中最小的,试写出该元素的电子结构式、名称及元素符号。
正确答案: 该元素的电子结构式[Ar]3d54s1、名称铬及元素符号Cr。 -
第22题:
多选题周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是()A电子数
B最外层电子数
C电子层数
D次外层电子数
正确答案: C,B解析: 元素周期表中16号元素为硫元素,次外层电子数为8,4号元素铍,其次外层电子数为2,故A、D正确。 -
第23题:
问答题针对核电荷数为1~20的元素,有人说:“元素的最高正化合价数值与元素原子的最外层电子数相等”。这一说法是否适用于除稀有气体元素以外的所有元素?请举例说明。正确答案: 以上说法只适用于主族元素,不适用于过渡元素。如锰元素最外电子层上只有2个电子,而它的最高正化合价为+7价;铜元素最外电子层上只有1个电子,而铜的常见化合价却是+2价。解析: 暂无解析
