关于氧化还原反应,以下叙述错误的是:()。A、被氧化的元素化合价一定升高B、被还原元素的化合价一定降低C、有氧元素参加的反应一定是氧化还原反应
题目
关于氧化还原反应,以下叙述错误的是:()。
- A、被氧化的元素化合价一定升高
- B、被还原元素的化合价一定降低
- C、有氧元素参加的反应一定是氧化还原反应
相似考题
更多“关于氧化还原反应,以下叙述错误的是:()。A、被氧化的元素化合价一定升高B、被还原元素的化合价一定降低C、有氧元素参加的反应一定是氧化还原反应”相关问题
-
第1题:
分析下列关于氧化、还原反应的描述,其中正确的是()A、氧化-还原反应一定要有氧气参与
B、没有氢气参与的反应不是氧化-还原反应
C、O2与H2反应生成水不是氧化-还原反应
D、有元素化合价变化的反应是氧化-还原反应
参考答案:D
-
第2题:
阅读下列材料.按要求完成任务。
材料一《普通高中化学课程标准(实验)》关于“氧化还原反应”的内容标准:根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。
材料二某版本教科书《化学1》的知识结构体系:
第一章从实验学化学
第二章化学物质及其变化
第一节物质的分类
第二节离子反应
第三节氧化还原反应
第三章金属及其化合物
第四章非金属及其化合物
材料三某版本教科书《化学1》第二章第三节“氧化还原反应”片段节选:
请分析下列3个氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。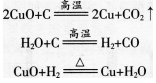
可以看出,在氧化还原反应中,某些元素的化合价在反应前后发生了变化。因此,我们可以说物质所含元素化合价升高的反应是氧化反应,物质所含元素化合价降低的反应是还原反应。
我们再看以下反应:
并非只有得氧、失氧的反应才是氧化还原反应,凡是有元素化合物升降的化学反应都是氧化还原反应。
例如.钠与氯气的反应属于金属与非金属的反应。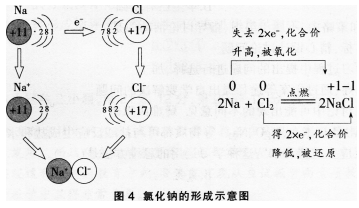
又如.氢气与氯气的反应属于非金属与非金属的反应。从它们的原子结构来看,氢原子的最外电子层上有1个电子,可获得1个电子而形成2个电子的稳定结构。氯原子的最外电子层上有7个电子.也可获得1个电子而形成8个电子的稳定结构。
通过以上分析,我们认识到有电子转移(得失或偏移)的反应,是氧化还原反应。氧化反应表现为被氧化的元素的化合价升高,其实质是该元素的原子失去(或偏离)电子的过程;还原反应表现为被还原的元素的化合价降低,其实质是该元素的原子获得(或偏向)电子的过程。
要求:
(1)氧化还原反应的判断依据是什么实质是什么
(2)确定本节课的三维教学目标。
(3)确定本节课的教学重点和难点。
(4)设计教学思路和教学板书。答案:解析:(1)氧化还原反应的判断依据是元素的化合价是否发生变化;氧化还原反应的实质是电子的转移(得失和偏移)。 (2)知识与技能目标:能够从化合价升降和电子转移的角度认识氧化还原反应;理解氧化还原反应的本质是电子的转移(得失和偏移),会用化合价的变化和电子转移的观点判断氧化还原反应。
过程与方法目标:通过对氧化还原的特征和本质的分析,学习由表及里以及由特殊到一般的逻辑推理方法。
情感态度与价值观目标:通过对“氧化”和“还原”这一典型矛盾的深入研究,深刻体会自然现象中的对立和
统一的关系,树立辩证唯物主义思想。
(3)重点:从化合价升降和电子转移的角度理解氧化还原反应;了解氧化还原反应的表示方法。
难点:理解氧化还原反应的实质;会用“双线桥”法分析氧化还原反应。



板书设计:
第三节氧化还原反应
一、基本概念:
氧化反应:得氧→化合价升高→失去(或偏离)电子
还原反应:失氧→化合价降低→得到(或偏向)电子
氧化还原反应:得失氧→化合价升降→电子转移(得失或偏移)
二、判断依据:
有元素化合价的变化
三、本质:
电子转移(得失或偏移) -
第3题:
关于氧化还原反应,以下叙述错误的是()
- A、被氧化的元素化合价一定升高
- B、被还原元素的化合价一定降低。
- C、有氧化元素参加的反应一定是氧化还原反应。
正确答案:C -
第4题:
在氧化-还原反应中,化合价升高的元素是被还原的。
正确答案:正确 -
第5题:
下列说法中错误的是()
- A、氧化剂得到电子,化合价降低,具有氧化性
- B、氧化剂得到电子,化合价降低,具有还原性
- C、氧化剂失去电子,化合价降低,具有氧化性
- D、氧化剂失去电子,化合价升高,具有还原性
- E、氧化剂得到电子,化合价升高,具有氧化性
正确答案:A,C,D,E -
第6题:
下列氧化、还原反应中正确的描述是()。
- A、所含元素化合价降低的物质是还原剂
- B、所含元素化合价升高的物质是还原剂
- C、物质所含元素化合价降低的反应就是氧化反应
- D、物质所含元素化合价升高的反应就是还原反应
正确答案:B -
第7题:
下列说法中,错误的是()。
- A、氧化剂本身被还原
- B、氧化剂是在反应中得到电子(或电子对偏向)的物质
- C、还原剂在反应时所含元素的化合价降低
- D、还原剂本身被氧化
正确答案:C -
第8题:
氧化-还原反应的实质是反应物的被氧化元素和被还原元素之间发生了电子转移。
正确答案:正确 -
第9题:
氧化-还原反应的实质是化合价的升高或降低。
正确答案:错误 -
第10题:
单选题关于氧化还原反应,以下叙述错误的是:()。A被氧化的元素化合价一定升高
B被还原元素的化合价一定降低
C有氧元素参加的反应一定是氧化还原反应
正确答案: C解析: 暂无解析 -
第11题:
单选题关于氧化还原反应,以下叙述错误的是()A被氧化的元素化合价一定升高
B被还原元素的化合价一定降低。
C有氧化元素参加的反应一定是氧化还原反应。
正确答案: A解析: 暂无解析 -
第12题:
判断题氧化-还原反应的实质是反应物的被氧化元素和被还原元素之间发生了电子转移。A对
B错
正确答案: 对解析: 暂无解析 -
第13题:
已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高。海洋中有丰富的资源,如下图所示利用海水可获得许多化工产品。下列有关说法正确的是 ( ) A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的试剂顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液,过滤后加盐酸
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的试剂顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液,过滤后加盐酸
B.第②步中加入的试剂为CaCl2溶液
C.第③步中发生分解反应
D.在第④步中溴元素被还原答案:C解析: -
第14题:
高中化学《氧化还原反应》
一、考题回顾


二、考题解析
【教学过程】
(一)导入新课
【教师提问】回忆一下初中学过的知识,什么是氧化反应,什么是还原反应,能不能举出几个具体的实例呢?
【学生回答】氧化反应:碳与氧气、铁与氧气……
还原反应:氢气还原氧化铜、碳还原氧化铜、一氧化碳还原氧化铜……
(二)新课讲授
1.氧化还原反应的特征
【提出问题】能不能举出其他的氧化还原反应?题目来源于考生回忆
【学生回答】碳与氧化铜的反应、氢气还原氧化铜……
【提出问题】观察一下所列举的几个化学方程式,除了得失氧之外,从化合价的角度思考什么是氧化还原反应?
【学生回答】得氧元素发生氧化反应,元素化合价升高;失氧元素发生还原反应,元素化合价降低。
【教师引导】由此可知,氧化还原反应的特征就是有元素化合价升降的变化。
【提出问题】铁与硫酸铜的反应是否属于氧化还原反应?是不是只有得失氧的化学反应才是氧化还原反应?
【学生回答】是,铁元素、铜元素的化合价都出现了变化。可知并不是只有得失氧的反应才是氧化还原反应。
2.氧化还原反应的本质
【提出问题】为什么在氧化还原反应中会出现化合价的升降变化?元素化合价的升降与什么有关?
【学生回答】元素化合价的变化与得失电子(电子转移)有关。题目来源于考生回忆
【教师引导】那么就从原子结构的角度揭秘在氧化还原反应中,元素的化合价为什么会发生变化。
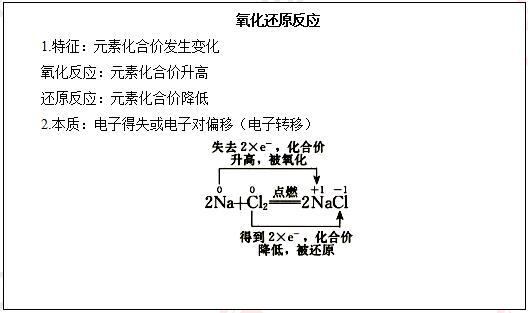
【提出问题】金属钠在氯气中燃烧生成NaCl,从原子结构示意图的角度思考NaCl是怎样形成的?
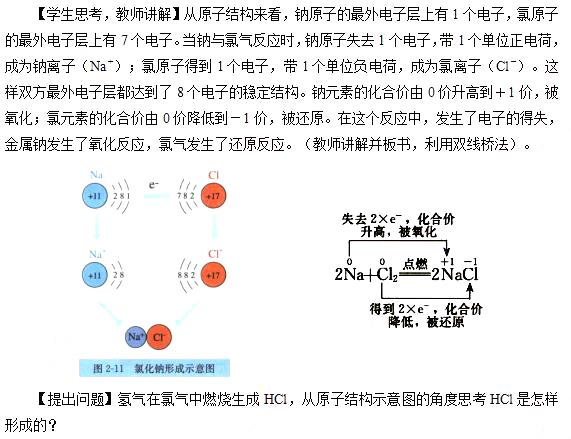
【学生思考,教师讲解】从原子结构来看,氢原子最外层有1个电子,可获得1个电子而形成2个电子的稳定结构。氯原子的最外电子层上有7个电子,也可获得1个电子而形成8个电子的稳定结构。
这两种元素的原子获取电子难易程度相差不大。在发生反应时,它们都未能把对方的电子夺取过来,而是双方各以最外层的1个电子组成一个共用电子对,这个电子对受到两个原子核的共同吸引,使对方最外电子层都达到稳定结构。在氯化氢分子里,由于氯原子对共用电子对的吸引力比氢原子的稍强一些,所以,共用电子对偏向氯原子而偏离于氢原子。因此,氢元素的化合价从0价升高到+1价,被氧化;氯元素的化合价从0价降低到-1价。在这个反应中,发生了共用电子对的偏移,氢气发生了氧化反应,氯气发生了还原反应。(教师讲解并板书)
【提出问题】根据以上的分析,能不能从电子转移的角度重新定义氧化还原反应?
【学生回答】有电子转移(得失或偏移)的反应,是氧化还原反应。(教师总结并板书)
【提出问题】能不能从电子转移的角度分析铁与硫酸铜的反应?题目来源于考生回忆
【学生回答】铁元素失去2个电子,化合价升高,发生氧化反应;铁元素得到2个电子,化合价降低,发生还原反应。(教师板书:利用双线桥法)
(三)巩固提升
【提出问题】有人说置换反应、有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应,你认为这个说法正确吗?请说明理由。
提示:正确。因为在这几类反应中,反应前后都有元素化合价发生变化。
(四)小结作业
请学生回答本堂课的收获:氧化还原反应的特征、本质,学到了什么?
布置作业:课下思考,四大反应类型与氧化还原反应有什么关系。
【板书设计】
【答辩题目解析】
1.说明四种基本反应类型与氧化还原反应之间的关系?
2.简单介绍一下本节课的设计思路?题目来源于考生回忆答案:解析:1、置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,化合反应及分解反应不一定是氧化还原反应。
2、复习旧识,引导发现→重新定义氧化还原反应→通过对比化学方程式发现氧化还原反应判断的方法→内化知识,总结出氧化还原反应的本质→教师讲解氧化还原反应的表示方法→巩固练习→归纳总结,预留任务。 -
第15题:
元素失去电子,化合价升高的过程是()。
- A、还原
- B、氧化
- C、中和
正确答案:B -
第16题:
物质失去电子(元素化合价升高)的反应称为()反应。
- A、氧化
- B、还原
- C、氧化还原
- D、歧化
正确答案:A -
第17题:
物质所含元素化合价升高的反应就是氧化反应,物质所含元素化合价降低的反应就是还原反应。
正确答案:正确 -
第18题:
对氧化还原反应,以下叙述错误的是()。
- A、被氧化的元素化合价一定升高
- B、氧化的化合价一定降低
- C、氧化剂中一定有元素被氧化
- D、还原剂中不一定有元素被氧化
- E、有氧元素参加的反应一定是氧化还原反应
正确答案:C,D,E -
第19题:
氧化一还原反应的实质是反应物的被氧化元素和被还原元素之间发生了电子转移。
正确答案:正确 -
第20题:
关于氧化还原反应,以下叙述错误的是:()。
- A、被氧化的元素化合价一定升高
- B、被还原元素的化合价一定降低
- C、有氧元素参加的反应一定是氧化还原反应
正确答案:C -
第21题:
在氧化还原反应中,还原剂中不一定有元素被氧化。
正确答案:错误 -
第22题:
单选题在氧化还原反映中,应选择()指示剂.A元素的原子得到电子
B元素的原子失去电子
C元素的化合价降低
D元素的化合价既不升高也不降低
正确答案: B解析: 暂无解析 -
第23题:
判断题氧化一还原反应的实质是反应物的被氧化元素和被还原元素之间发生了电子转移。A对
B错
正确答案: 错解析: 暂无解析 -
第24题:
单选题当发生氧化还原反应时,氧化剂中必发生()。A元素的化合价升高现象
B元素的化合价降低现象
C元素的化合价不改变
正确答案: B解析: 暂无解析
